Table of Contents
Toggleপর্যায় সারণি এবং মৌলের ধর্মের পর্যাবৃত্ততা
-
ডোবেরাইনারের ত্রয়ী সূত্র
রাসায়নিক ধর্মে সদৃশ এমন তিনটি মৌলকে তাদের পারমাণবিক ভরের ক্রম অনুযায়ী সাজালে প্রান্তীয় মৌল দুটির পারমাণবিক গুরুত্বের গড় মাঝের মৌলটির পারমাণবিক গুরুত্বের সমান বা প্রায় সমান হয়।
যেমন- Li, Na ও K এর পারমাণবিক ভর যথক্রমে 6.94, 23 ও 39.1। ত্রয়ী সূত্র অনুযায়ী Li ও K-এর পারমাণবিক ভরের গড় \frac{6.94+39.1}{2} =23.01। যা মাঝের মৌল Na-এর পারমাণবিক ভরের প্রায় সমান।
একইভাবে, Be, Mg ও Ca এর পারমাণবিক ভর যথক্রমে 9.013, 24.32 ও 40.08। ত্রয়ী সূত্র অনুযায়ী Be ও Ca-এর পারমাণবিক ভরের গড় \frac{9.103+40.08}{2}=24.551। যা মাঝের মৌল Mg-এর পারমাণবিক ভরের প্রায় সমান।
- হালকা মৌলগুলির ক্ষেত্রে ত্রয়ীর সূত্র প্রযোজ্য হলেও ভারী মৌলের ক্ষেত্রে এই সূত্রটি কাজে লাগে না। তাই পরবর্তীতে ত্রয়ীর সূত্রটি পরিত্যক্ত হয়।
-
নিউল্যান্ডের অষ্টক সূত্র
মৌলগুলিকে তাদের পারমাণবিক ভরের ক্রমানুসারে সাজালে প্রথম মৌলটির সঙ্গে অষ্টম মৌলের ভৌত ও রাসায়নিক ধর্মের মিল পাওয়া যায়।
| Li (6.94) |
Be (9.013) |
B (10.82) |
C (12.01) |
N (14.008) |
O (16) |
F (19) |
| Na (23) |
Mg (24.32) |
Al (26.98) |
Si (28.09) |
P (30.975) |
S (32.066) |
Cl (35.45) |
| K (39.10) |
উপরের সারণিতে মৌলগুলিকে তাদের পারমাণবিক ভরের ভিত্তিতে ক্রমানুযায়ী সাজানো হয়েছে। এই সারিতে লক্ষ্য করলে দেখা যাবে, Li-কে প্রথম মৌল হিসেবে ধরলে অষ্টম মৌলটি হয় Na। এদের রাসায়নিক ধর্মে মিল রয়েছে। আবার B-কে প্রথম মৌল ধরে এগোলে অষ্টম মৌলটি দাঁড়ায় Al। এদের মধ্যেও রাসায়নিক ধর্মের মিল রয়েছে।
- ভারী মৌলগুলির ক্ষেত্রে সূত্রটি প্রযোজ্য না হওয়ায় পরবর্তীতে এই সূত্রটিও পরিত্যাক্ত হয়।
-
মেন্ডেলিভের পর্যায় সারণি-
বিভিন্ন মৌলগুলিকে তাদের বর্ধিত পারমাণবিক ভর অনুসারে সাজালে দেখা যায় যে তাদের ভৌত ও রাসায়নিক ধর্মগুলি পর্যায়ক্রমে পুনরাবৃত্ত হচ্ছে।
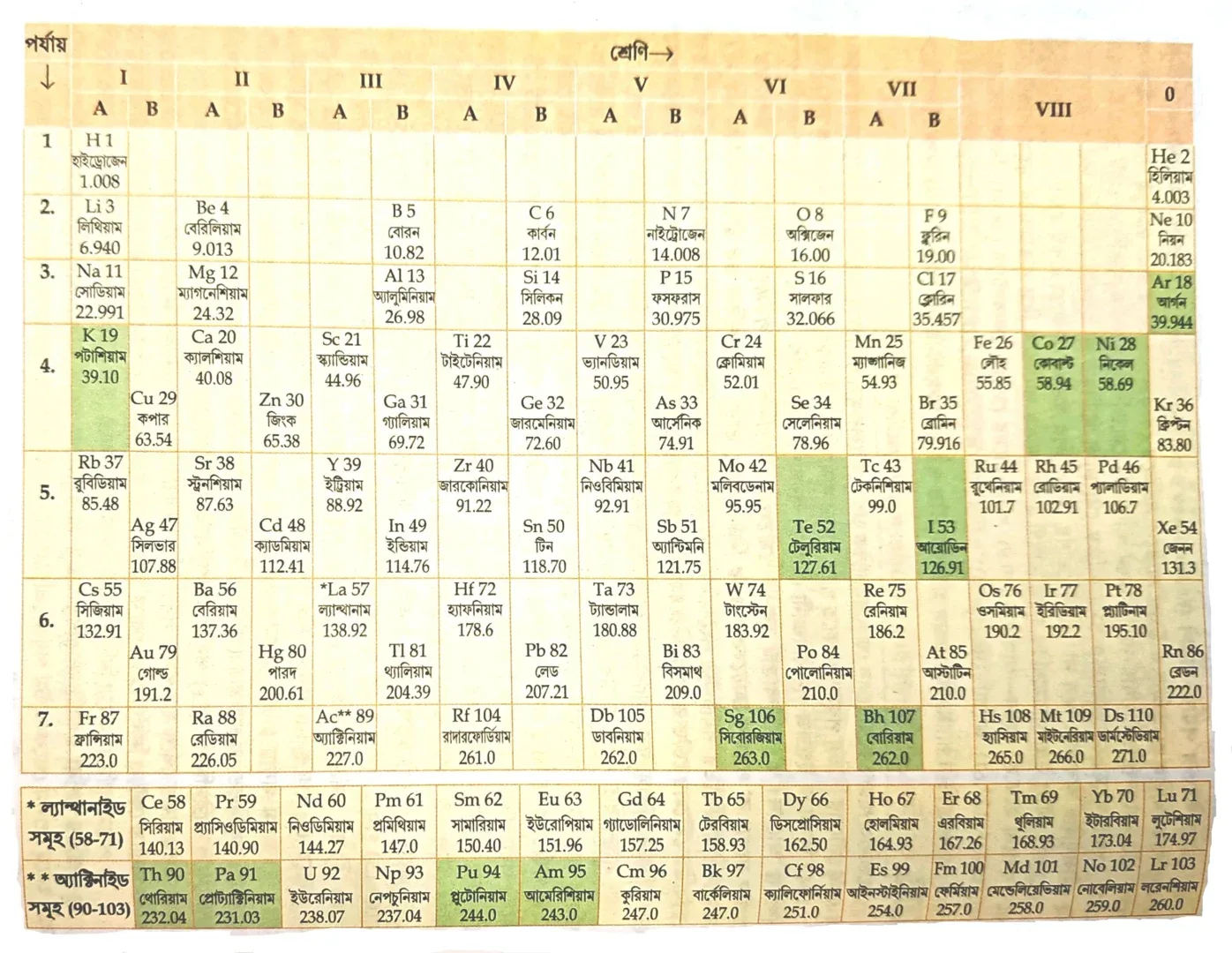
মেন্ডেলিভের দীর্ঘ পর্যায় সারণির বৈশিষ্ট্য-
- মেন্ডেলিভের পর্যায় সারণি ক্রমবর্ধমান পারমাণবিক ভরের ভিত্তিতে সজ্জিত।
- মেন্ডেলিভের 7 টি পর্যায় ও 9 টি শ্রেণি। 9 টি শ্রেণিকে I, II, III, … VIII পর্যন্ত সাজানো হয়েছে। তবে নবম শ্রেণি টিকে শূন্য শ্রেণি হিসেবে চিহ্নিত করা হয়েছে।
- I থেকে VII পর্যন্ত প্রতিটি শ্রেণিকে A ও B দিয়ে দুটি উপশ্রেণিতে বিভক্ত করা হয়েছে। VIII শ্রেণিকে 3 টি অংশে বিভক্ত করা হয়েছে।
- এই শ্রেণির ষষ্ঠ পর্যায়ে IIIA-কে ল্যান্থানাইড (বিরল মৃত্তিকা) ও সপ্তম পর্যায়ের IIIA- কে অ্যাক্টিনাইড সমূহ বলা হয়।
মেন্ডেলিফের পর্যায় সারণির ত্রুটি
- হাইড্রোজেনের অবস্থান- মেন্ডেলিভ পর্যায় সারণিতে হাইড্রোজেনকে বসানোর সময় লক্ষ্য করেন যে এই মৌলটির কিছু ধর্ম Gr-IA এবং Gr-VIIB (হ্যালোজেন) এর সঙ্গে মিলে যায়।
Gr-IA এর সঙ্গে সদৃশ
(i) ক্ষার ধাতুগুলির মত হাইড্রোজেনের যোজ্যতা 1
(ii) ক্ষার ধাতুর মত হাইড্রোজেন একটি তড়িৎ ধনাত্মক মৌল
(iii) ক্ষার ধাতুর মত হাইড্রোজেন অধাতুর সঙ্গে বিক্রিয়া করে যৌগ গঠন করে এবং দ্রবণে H^+ আয়ন তৈরি করে। যেমন-HCl, HBr, H_2S ইত্যাদি।
Gr-VIIB এর সঙ্গে সদৃশ
(i) হ্যালোজেন মৌলগুলির মত হাইড্রোজেন পরমাণু দ্বিপারমাণবিক।
(ii) ফ্লুরিন, ক্লোরিন এর মত হাইড্রোজেনও একটি গ্যাসীয় মৌল ।
(iii) হ্যালোজেন মৌলগুলির মত হাইড্রোজেন মৌলটি ধাতুর সঙ্গে বিক্রিয়া করে যৌগ তৈরি করে। যেমন- LiH, NaH, CaH_2।
এই দুটি গ্রুপের সঙ্গে হাইড্রোজেনের মিল থাকায় মেন্ডেলিভ হাইড্রোজেনকে কোন স্থানে বসাবেন তা নিয়ে দ্বিধায় ছিলেন। সেজন্য তিনি হাইড্রোজেনকে দুষ্ট মৌল বলে আখ্যা দেন।
- পারমাণবিক ভরের গরমিল- মেন্ডেলিভ যদিও তার পর্যায় সারণিটি ক্রমবর্ধমান পারমাণবিক ভর অনুসারে সাজিয়েছেন তবুও কিছু কিছু ক্ষেত্রে তিনি মৌলগুলিকে পারমাণবিক ভর অনুসারে না সাজিয়ে তাদের ভৌত ও রাসায়নিক ধর্মে ভিত্তিতে বসিয়েছেন। যেমন- Ar এর পরে K রয়েছে। যদিও এদের পারমাণবিক ভর যথাক্রমে 39.944 ও 39.10। একইভাবে, Co (58.94) এর পরে Ni (58.69) রয়েছে।
- আইসোটোপের অবস্থান- কোনো মৌলের একাধিক আইসোটোপ থাকলে তাদের পারমাণবিক ভর আলাদা হবে। তা সত্ত্বেও এদের অবস্থান মেন্ডেলিভ এই পর্যায় সারণিতে একটি স্থানে রেখেছেন।
- ল্যান্থানাইড ও অ্যাক্টিনাইড শ্রেণির অবস্থান- এই দুই ধরনের মৌলগুলিকে তিনি ঠিকমতো বসাতে পারেননি।
- পর্যাবৃত্ততার কারণ- মেন্ডেলিভ মৌলগুলিকে সাজালেও এদের ভৌত ও রাসায়নিক ধর্মের পর্যায়বৃত্ততার কারণ ব্যাখ্যা করতে পারেননি।
মেন্ডেলিফের পর্যায়ে সারণির সাফল্যতা-
- পর্যায়বৃত্ততা- মেন্ডেলিভ তার সারণির মাধ্যমে মৌলগুলিকে সনাক্ত করতে পেরেছেন।
- অনাবিষ্কৃত মৌলের অনুমান- মেন্ডেলিভ কিন্তু তার পর্যায় সারণিকে সম্পূর্ণরূপে পূরণ করতে পারেননি। কিছু স্থান তিনি ফাঁকা রেখেছিলেন। যা পরবর্তীকালে গ্যালিয়াম ও জার্মেনিয়াম দ্বারা পূরণ হয়।
-
আধুনিক দীর্ঘ পর্যায় সারণি
মৌলদের রাসায়নিক ধর্ম পারমাণবিক ভরের ওপর নির্ভর করে না। এটি নির্ভর করে কক্ষপথে অবস্থিত ইলেকট্রন বিন্যাসের উপর। কোনো পরমাণুর ইলেকট্রন সংখ্যা ও প্রোটন সংখ্যা সমান। তাই মৌলগুলিকে পারমাণবিক ক্রমাঙ্ক অনুযায়ী সাজালে মৌলগুলির ভৌত ও রাসায়নিক ধর্মের মিল পাওয়া যাবে।
সূত্র- বিভিন্ন মৌলগুলির ভৌত ও রাসায়নিক ধর্ম তাদের পারমাণবিক ক্রমাঙ্ক অনুসারে পুনরাবৃত্ত হয়।
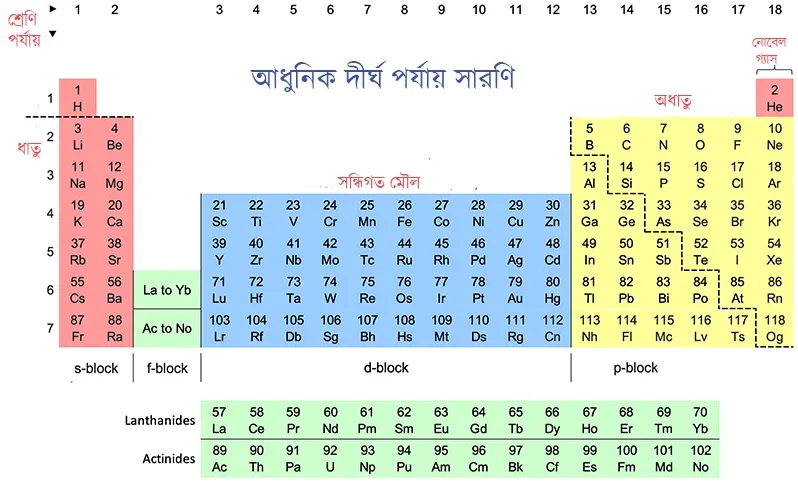
আধুনিক দীর্ঘ পর্যায় সারণি বৈশিষ্ট্য-
- আধুনিক পর্যায় সারণি পারমাণবিক ক্রমাঙ্কের ভিত্তিতে তৈরি।
- 7 টি পর্যায় ও 18 টি শ্রেণি রয়েছে।
পর্যায়গুলির বিবরণ-
| পর্যায় | পর্যায়ের নাম | মৌল সংখ্যা |
| প্রথম | অতি হ্রস্ব পর্যায় | 2 |
| দ্বিতীয় | প্রথম হ্রস্ব পর্যায় | 8 |
| তৃতীয় | দ্বিতীয় হ্রস্ব পর্যায় | 8 |
| চতুর্থ | প্রথম দীর্ঘ পর্যায় | 18 |
| পঞ্চম | দ্বিতীয় দীর্ঘ পর্যায় | 18 |
| ষষ্ঠ | অতি দীর্ঘ পর্যায় | 32 |
| সপ্তম | অসম্পূর্ণ পর্যায়। | - |
শ্রেণিগুলির বিবরণ
| শ্রেণি | নাম | উদাহরণ |
| 1 | ক্ষার ধাতু | Li, Na, K, Rb, Cs |
| 2 | ক্ষারীয় মৃত্তিকা ধাতু | Be, Mg, Ca, Sr, Ba |
| 3-12 | সন্ধিগত মৌল | Ti, V, Cr, Fe, Mo, |
| 13 | বোরন শ্রেণি | B, Al, Ga, In |
| 14 | কার্বন শ্রেণি | C, Si, Ge, Sn |
| 15 | নিকটোজেন (Pnictogen) | N, P, As, Sb, Bi |
| 16 | চ্যালকোজেন (Chalcogens) | O, S, Se, Te |
| 17 | হ্যালোজেন (Halogens) | F, Cl, Br, I |
| 18 | নোবেল গ্যাস | He, Ne, Ar, Kr, Xe, Rn |
- নিকটোজেন কথাটির অর্থ হলো দম বন্ধ হয়ে যাওয়া বা শ্বাসরুদ্ধ হওয়া।
- চালকোজেন কথাটির অর্থ হল আকরিক।
- হ্যালোজেন কথাটি এসেছে হ্য্যালাইড থেকে। এর অর্থ হল সামুদ্রিক লবণ।
-
মৌলের ধর্মের পর্যাবৃত্ততা
এটা জানার আগে দেখে নেওয়া যাক কয়েকটি মৌলের ইলেকট্রন বিন্যাস।
দ্বিতীয় পর্যায়টি ধরে নেওয়া যাক
{}_{3}Li - 2,1
{}_{4}Be - 2, 2
{}_{5}B - 2, 3
{}_{6}C - 2, 4
{}_{7}N - 2, 5
সিদ্ধান্ত- কোনো পর্যায়ের বাম দিক থেকে ডান দিকে গেলে কক্ষপথ সংখ্যা একই থাকে কিন্তু বাইরের কক্ষে একটি করে ইলেকট্রন বৃদ্ধি পেতে থাকে।
আবার, 17 নং শ্রেণিটি ধরা যাক
{}_{9}F - 2, 7
{}_{17}Cl - 2, 8, 7
{}_{35}Br - 2, 8, 18, 7
{}_{53}I - 2, 8, 18,18, 7
সিদ্ধান্ত- কোনো শ্রেণির উপর থেকে নীচে নামলে কক্ষপথের সংখ্যা একটি করে বৃদ্ধি পায় কিন্তু বাইরের কক্ষে একই সংখ্যক ইলেকট্রন থাকে।
5.1 পারমাণবিক ব্যাসার্ধ-
পর্যায়ে পরিবর্তন- কোনো পর্যায়ের বাঁ দিক থেকে ডান দিকে গেলে কক্ষপথ সংখ্যা একই থাকলেও শেষ কক্ষপথে একটি করে ইলেকট্রন বৃদ্ধি পেতে থাকে এবং একই সঙ্গে নিউক্লিয়াসের মধ্যে একটি করে প্রোটন বাড়তে থাকে। ফলে সর্ব বহিঃস্থ কক্ষের ইলেকট্রনের সঙ্গে নিউক্লিয়াসের আকর্ষণ বল বৃদ্ধি পেতে থাকে। তাই কক্ষপথের ব্যাসার্ধ হ্রাস পায়।

পর্যায়ের বাঁ দিক থেকে ডান দিকে গেলে কক্ষপথের ব্যাসার্ধ হ্রাস পায়।
শ্রেণিতে পরিবর্তন- কোনো শ্রেণির উপর থেকে নিচে নামলে শেষ কক্ষপথে ইলেকট্রন সংখ্যা একই থাকছে কিন্তু একটি করে কক্ষপথ বৃদ্ধি পাচ্ছে। যেহেতু নতুন কক্ষপথ পাওয়া যাচ্ছে তাই উপর থেকে নিচে নামলে পরমাণুর আকার বৃদ্ধি পাবে।
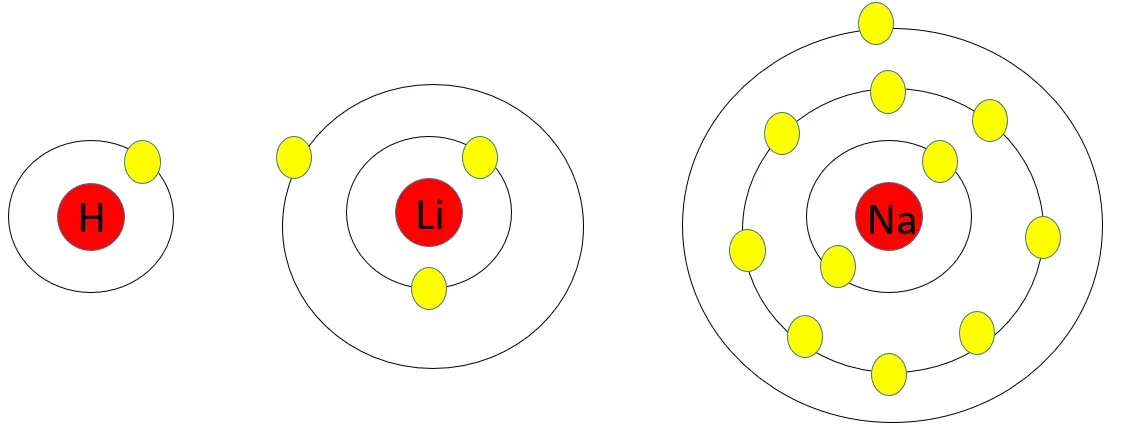
কোনো শ্রেণির উপর থেকে নিচে নামলে পরমাণুর আকার বৃদ্ধি পাবে।
5.2 আয়োনাইজেশন শক্তি/ বিভব-
গ্যাসীয় অবস্থায় থাকা কোনো মৌলের কোনো প্রশম এবং বিচ্ছিন্ন পরমাণু যখন সর্বনিম্ন শক্তিস্তরে থাকে তখন পরমাণুর সবচেয়ে বাইরের কক্ষের সবচেয়ে আলগাভাবে আবদ্ধ ইলেকট্রনটিকে নিউক্লিয়াসের আকর্ষণ থেকে সম্পূর্ণরূপে বিচ্ছিন্ন করে একটি ধনাত্মক আয়নে পরিণত করতে নূন্যতম যে পরিমাণ শক্তির প্রয়োজন তাকে ওই মৌলের প্রথম আয়নাইজেশন শক্তি বলে।
একক eV।
পরমাণুর আকার যত ছোটো হবে সর্ব্বহিস্থ কক্ষের ইলেকট্রনগুলির ওপর আকর্ষণ বল তত তীব্র হবে।
শ্রেণিতে পরিবর্তন- কোনো শ্রেণির মধ্যে উপর থেকে নিচে নামলে পরমাণুর আকার বৃদ্ধি পায়। সেজন্য আয়োনাইজেশন বিভব কমতে থাকে।
| প্রথম শ্রেণির মৌল | H | Li | Na | K |
| আয়োনাইজেশন বিভব (eV) | 13.96 | 5.39 | 5.139 | 4.34
|
| দ্বিতীয় শ্রেণির মৌল | Be | Mg | Ca |
| আয়োনাইজেশন বিভব (eV) | 9.32 | 7.65 | 6.11 |
| 17 নং শ্রেণির মৌল | F | Cl | Br | I |
| আয়োনাইজেশন বিভব (eV) | 17.42 | 12.97 | 11.81 | 10.45
|
পর্যায়ে পরিবর্তন- কোনো পর্যায়ের বাঁ দিক থেকে ডান দিকে গেলে পরমাণুর আকার ছোটো হওয়ায় আয়োনাইজেশন বিভব বৃদ্ধি পায়।
| দ্বিতীয় পর্যায়ের মৌল | Li | Be | B | C | N | O | F | Ne |
| আয়োনাইজেশন বিভব (eV) | 5.39 | 9.32 | 8.30 | 11.26 | 14.53
|
13.61 | 17.42 | 21.56 |
5.3 তড়িৎ ঋণাত্মকতা -
অন্য কোনো মৌলের পরমাণুর সঙ্গে সমযোজী বন্ধন দ্বারা আবদ্ধ থাকাকালীন অবস্থায় বন্ধন সৃষ্টিকারী ইলেকট্রন-জোড়কে কোনো মৌলের পরমাণুর নিজের দিকে আকর্ষণ করার ক্ষমতাকে মৌলটির তড়িৎ ঋণাত্মকতা বলে।

- পরমাণুর আকার যত ছোটো হবে সর্ব্বহিস্থ কক্ষের ইলেকট্রনগুলির ওপর আকর্ষণ বল তত তীব্র হবে। অর্থাৎ আকার ছোটো হলে তড়িৎ ঋণাত্মকতা বৃদ্ধি পায়।
শ্রেণিতে পরিবর্তন- কোনো শ্রেণির মধ্যে উপর থেকে নিচে নামলে পরমাণুর আকার বৃদ্ধি পায়। সেজন্য তড়িৎ ঋণাত্মকতা কমতে থাকে। যেমন- F>Cl>Br>I
পর্যায়ে পরিবর্তন- কোনো পর্যায়ের বাঁ দিক থেকে ডান দিকে গেলে পরমাণুর আকার ছোটো হওয়ায় তড়িৎ ঋণাত্মকতা বৃদ্ধি পায়। যেমন- C<N<O<F
- সর্বোচ্চ তড়িৎ ঋণাত্মকতা সম্পন্ন পরমাণুটি হল ফ্লুরিন (F)।
5.4 জারণ বিজারণ ধর্ম-

- ইলেকট্রন গ্রহণের প্রবণতা যত বেশি=> তত শক্তিশালী জারক
- ইলেকট্রন ত্যাগের প্রবণতা যত বেশি=> তত শক্তিশালী বিজারক
শ্রেণিতে পরিবর্তন-
বিজারণ ক্ষমতা ক্রম: Be<Mg<Ca<Sr<Ba
জারণ ক্ষমতা ক্রম: F>Cl>Br>I
পর্যায়ে পরিবর্তন-
বিজারণ ক্ষমতা ক্রম: Na>Mg>Al>Si>P>S>Cl
জারণ ক্ষমতা ক্রম:Na<Mg<Al<Si<P<S<Cl
মৌলের পর্যাবৃত্ততা ধর্ম নয়- তেজস্ক্রিয়তা, চৌম্বক ধর্ম দ্রাব্যতা ইত্যাদি।




 ABC প্রিজমের প্রতিসারক কোণ ∠A। PQ রশ্মি AC তলে ∠
ABC প্রিজমের প্রতিসারক কোণ ∠A। PQ রশ্মি AC তলে ∠