Table of Contents
Toggleরাসায়নিক বন্ধন Notes Class 10
রাসায়নিক বন্ধন
এই মহাবিশ্বে যতগুলি মৌল রয়েছে তাদের মধ্যে নিষ্ক্রিয় মৌলগুলির কক্ষপথে সর্বোচ্চ সংখ্যক ইলেকট্রন থাকে। এই অবস্থায় মৌলগুলি সর্বনিম্ন শক্তিস্তরে অবস্থান করে।
অন্যান্য মৌলগুলিও ইলেকট্রন গ্রহণ, বর্জন বা পরস্পরের ইলেকট্রন ব্যবহারের মাধ্যমে কক্ষপথে সর্বোচ্চ ইলেকট্রন বিন্যাস লাভ করে ও তুলনামূলকভাবে স্থায়িত্ব পায়। একে রাসায়নিক বন্ধন বলে।
রাসায়নিক বন্ধন মূলত চার প্রকার। (i) আয়নীয় বা তড়িতযোজী বন্ধন, (ii) সমযোজী বন্ধন, (iii) ধাতব বন্ধন ও (iv) হাইড্রোজেন বন্ধন।
WBBSE দশম শ্রেণি অনুযায়ী সিলেবাসে আয়নীয় ও সমযোজী বন্ধন রয়েছে।
ইলেকেট্রন গ্রহণ বা বর্জন বা আদান প্রদানের ক্ষেত্রে বহিঃস্থ কক্ষে 8 টি ইলেকট্রন হওয়ার ঘটনাকে অষ্টক পূর্তি বলে। যদি, বহিঃস্থ কক্ষে 2 টি ইলেকট্রন হয় তাহলে একে দ্বৈত পূর্তি বলে বলা হবে।
1. আয়নীয় বন্ধন-
বিজ্ঞানী কোসেল (Kossel) প্রথম এর ধারণা দেন।
যে বন্ধনে ভিন্ন প্রকৃতির একাধিক পরমাণু তাদের নিকটবর্তী নিষ্ক্রিয় মৌলের মত ইলেকট্রন বিন্যাস লাভের চেষ্টায় একটি ইলেকট্রন ত্যাগ এবং অপরটি সেই ইলেকট্রন গ্রহণের মাধ্যমে আয়ন তৈরি করবে এবং তড়িৎ আকর্ষণের প্রভাবে কাছাকাছি আসবে। একে তড়িৎযোজী বা আয়নীয় বন্ধন বলে।
ধর্ম-
(i) ভৌত অবস্থা-সাধারণ অবস্থায় তড়িৎযোজী যৌগগুলি কঠিন এবং কেলাসাকার।
(ii) গলনাঙ্ক ও স্ফুটনাঙ্ক- এদের গলনাঙ্ক ও স্ফুটনাঙ্ক সাধারণত অনেক বেশি হয়।
(iii) তড়িৎ পরিবাহিতা- কঠিন অবস্থায় তড়িৎ পরিবহন করে না তবে গলিত বা জলে দ্রবীভূত অবস্থায় তড়িৎ পরিবহনে সক্ষম।
(iv) দ্রাব্যতা- আয়নীয় যৌগগুলি জলের মতো ধ্রুবীয় দ্রাবকে দ্রবীভূত হয় কিন্তু অধ্রুবীয় দ্রাবক যেমন- কার্বন-ডাই-সালফাইড (CS_2), কার্বন টেট্রাক্লোরাইড (CCl_4) বেঞ্জিন (C_6H_6)-এ দ্রবীভূত হয় না।
(v) সমাবয়বতার দেখা যায় না।
1.1 লিথিয়াম হাইড্রাইড-এর গঠন

Li- এর ইলেকট্রন বিন্যাস 2, 1
H- এর ইলেকট্রন বিন্যাস 1
একটি লিথিয়াম (Li) পরমাণু তার বহিঃস্থ কক্ষের 1 টি ইলেকট্রন ত্যাগ করে দ্বৈত পূর্তির মাধ্যমে নিকটবর্তী নিষ্ক্রিয় মৌল হিলিয়ামের মতো ইলেকট্রন বিন্যাস লাভ করে এবং Li^{+} আয়ন তৈরি করে।
অন্যদিকে, 1টি হাইড্রোজেন (H) পরমাণু ওই 1টি ইলেকট্রন গ্রহণ করে নিজেও দ্বৈত পূর্তি করবে ও H^{-} আয়ন তৈরি করে।
আয়ন দুটি তীব্র তড়িৎ আকর্ষণ বলের প্রভাবে পরস্পরের কাছে আসে ও LiH অণু তৈরি করে।
Li ও H; উভয়ের যোজ্যতা 1।
1.2 সোডিয়াম ক্লোরাইড-এর গঠন
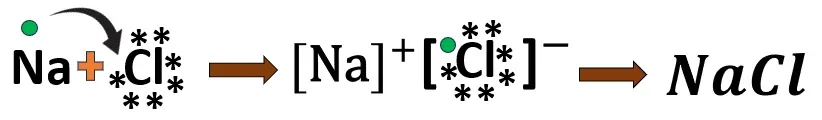
Na- এর ইলেকট্রন বিন্যাস 2, 8, 1
Cl- এর ইলেকট্রন বিন্যাস 2, 8, 7
একটি সোডিয়াম (Na) পরমাণু তার বহিঃস্থ কক্ষের 1 টি ইলেকট্রন ত্যাগ করে অষ্টক পূর্তির মাধ্যমে নিকটবর্তী নিষ্ক্রিয় মৌল নিয়নের মতো ইলেকট্রন বিন্যাস লাভ করে এবং Na^{+} আয়ন তৈরি করে।
অন্যদিকে, 1টি ক্লোরিন (Cl) পরমাণু ওই 1টি ইলেকট্রন গ্রহণ করে আর্গনের মতো ইলেকট্রন বিন্যাস লাভ করবে ও Cl^{-} আয়ন তৈরি করে।
আয়ন দুটি তীব্র তড়িৎ আকর্ষণ বলের প্রভাবে পরস্পরের কাছে আসে ও NaCl অণু তৈরি করে।
Na ও Cl; উভয়ের যোজ্যতা 1।
NaCl কেলাস
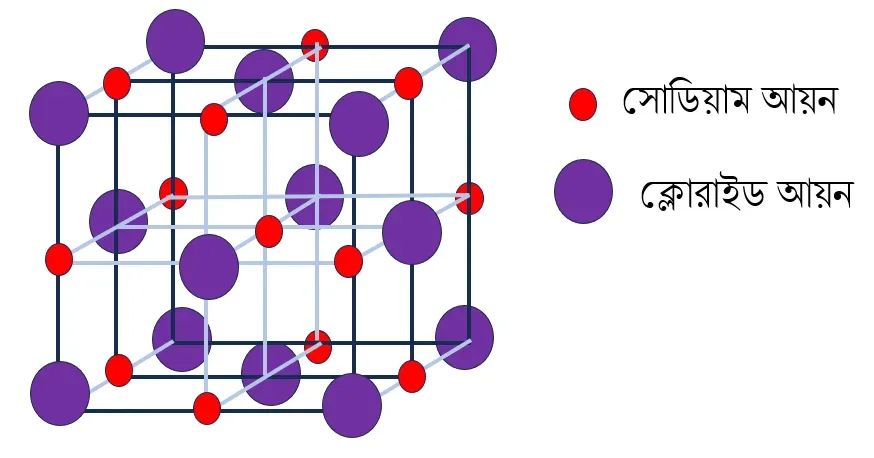
সোডিয়াম ক্লোরাইডের কেলাসে একটি Na^{+} আয়নের ছয় পাশে 6টি Cl^{-} আয়ন এবং একটি Cl^{-} আয়নের ছয় পাশে 6টি সোডিয়াম আয়ন থাকে।
1.3 ক্যালসিয়াম অক্সাইড-এর গঠন
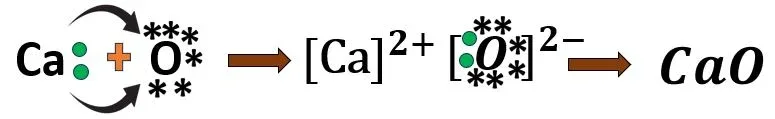
Ca পরমাণুর ইলেকট্রন বিন্যাস- 2, 8, 8, 2
O পরমাণুর ইলেকট্রন বিন্যাস- 2, 6
ক্যালসিয়াম পরমাণু তার বহিঃস্থ কক্ষের দুটি ইলেকট্রন ত্যাগ করলে আর্গনের মতো ইলেকট্রন বিন্যাস লাভ করে। সেই দুটি ইলেকট্রন অক্সিজেন পরমাণু দ্বারা গৃহীত হয় এবং নিয়নের মতো ইলেকট্রন বিন্যাস লাভ করে। এর ফলে Ca2+ ও O2- আয়ন তৈরি হয়। যা কুলম্বীয় বলের প্রভাবে কাছাকাছি এসে CaO তৈরি করে।
Ca ও O; উভয়ের যোজ্যতা 2।
1.4 ম্যাগনেসিয়াম ক্লোরাইড-এর গঠন
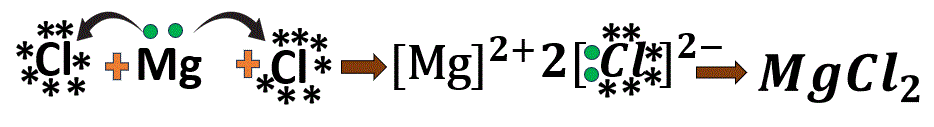
Mg- এর ইলেকট্রন বিন্যাস 2, 8, 2
Cl- এর ইলেকট্রন বিন্যাস 2, 8, 7
একটি ম্যাগনেসিয়াম (Mg) পরমাণু তার বহিঃস্থ কক্ষের 2 টি ইলেকট্রন ত্যাগ করে অষ্টক পূর্তির মাধ্যমে নিকটবর্তী নিষ্ক্রিয় মৌল নিয়নের মতো ইলেকট্রন বিন্যাস লাভ করে এবং Mg^{2+} আয়ন তৈরি করে।
অন্যদিকে, 2টি ক্লোরিন (Cl) পরমাণু ওই 1টি করে ইলেকট্রন গ্রহণ করে আর্গনের মতো ইলেকট্রন বিন্যাস লাভ করবে ও দুটি Cl^{-} আয়ন তৈরি করে।
আয়নগুলি তীব্র তড়িৎ আকর্ষণ বলের প্রভাবে পরস্পরের কাছে আসে ও MgCl_2 অণু তৈরি করে।
Mg-এর যোজ্যতা 2 ও Cl-এর যোজ্যতা 1।
1.5 সোডিয়াম ফ্লুরাইডের-এর গঠন
Na- এর ইলেকট্রন বিন্যাস 2, 8, 1
Cl- এর ইলেকট্রন বিন্যাস 2, 7
একটি সোডিয়াম (Na) পরমাণু তার বহিঃস্থ কক্ষের 1 টি ইলেকট্রন ত্যাগ করে অষ্টক পূর্তির মাধ্যমে নিকটবর্তী নিষ্ক্রিয় মৌল নিয়নের মতো ইলেকট্রন বিন্যাস লাভ করে এবং Na^{+} আয়ন তৈরি করে।
অন্যদিকে, 1টি ফ্লুরিন (F) পরমাণু ওই 1টি ইলেকট্রন গ্রহণ করে সেও নিয়নের মতো ইলেকট্রন বিন্যাস লাভ করবে ও F^{-} আয়ন তৈরি করে।
আয়ন দুটি তীব্র তড়িৎ আকর্ষণ বলের প্রভাবে পরস্পরের কাছে আসে ও NaF অণু তৈরি করে।
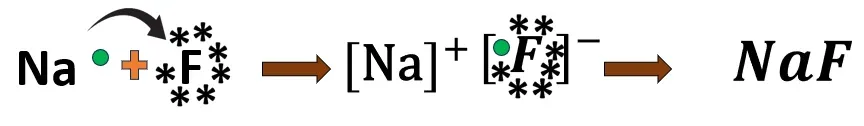
2. সমযোজী বন্ধন-
বিজ্ঞানী লুইস (Lewis) সমযোজী বন্ধনের ধারণা দেন। এক্ষেত্রে দুটি সমধর্মী মৌল একত্রিত হয়ে অণু তৈরি করে। উভয় মৌল তাদের সর্ববহিঃস্থ কক্ষের সমপরিমাণ ইলেকট্রন ব্যবহার করে এক বা একাধিক ইলেকট্রন জোড় তৈরির মাধ্যমে রাসায়নিক বন্ধন তৈরি করে।
ধর্ম-
(i) ভৌত অবস্থা-সাধারণ অবস্থায় সমযোজী যৌগ গুলি কঠিন, তরল বা গ্যাসীয় হতে পারে।
(ii) গলনাঙ্ক ও স্ফুটনাঙ্ক- এদের গলনাঙ্ক ও স্ফুটনাঙ্ক সাধারণত কম হয়।
(iii) তড়িৎ পরিবাহিতা- কঠিন, তরল বা গ্যাসীয় কোনো অবস্থাতেই তড়িৎ পরিবহন করে না।
(iv) দ্রাব্যতা- আয়নীয় যৌগগুলি জলের মতো ধ্রুবীয় দ্রাবকে দ্রবীভূত হয় না কিন্তু অধ্রুবীয় দ্রাবক যেমন- কার্বন-ডাই-সালফাইড (CS_2), কার্বন টেট্রাক্লোরাইড (CCl_4) বেঞ্জিন (C_6H_6)-এ দ্রবীভূত হয়।
(v) অনেকগুলি সমযোজী যৌগে সমাবয়বতার দেখা যায়।
সমযোজী বন্ধনের লুইস বিন্দু গঠন- ইলেকট্রনকে বিন্দুর সাহায্যে প্রকাশিত করে দুটি পরমাণুর মধ্যে একজোড়া বিন্দু বসিয়ে সমযোজী যৌগের বন্ধন প্রকাশ করা হয়।
2.1 হাইড্রোজেন অণুর গঠন
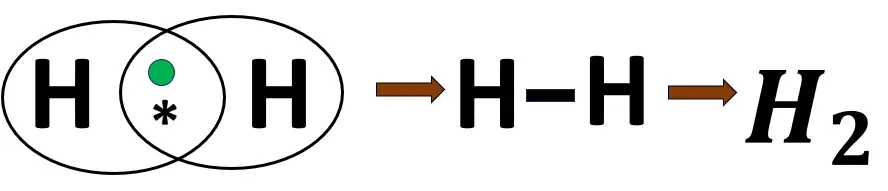
H -এর ইলেকট্রন বিন্যাস- 1
2 টি H পরমাণু একে অপরের 1টি ইলেকট্রন ব্যবহার করে নিকটবর্তী নিষ্ক্রিয় মৌল হিলিয়াম (He)-এর মতো ইলেকট্রন বিন্যাস লাভ করে। বন্ধনে এক জোড়া ইলেকট্রন থাকায় এটি সমযোজী একবন্ধন।
2.2 ফ্লুরিন অণুর গঠন
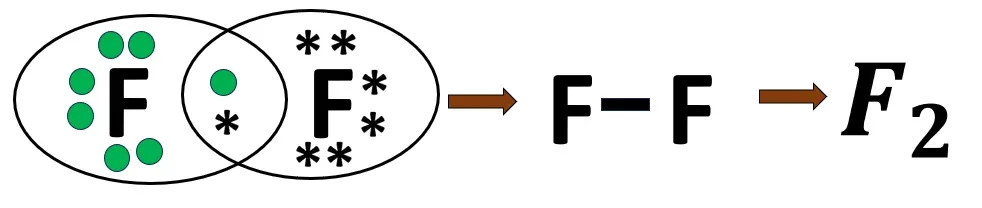
F -এর ইলেকট্রন বিন্যাস- 2, 7
2 টি F পরমাণু একে অপরের 1টি ইলেকট্রন ব্যবহার করে নিকটবর্তী নিষ্ক্রিয় মৌল নিয়ন (Ne)-এর মতো ইলেকট্রন বিন্যাস লাভ করে। বন্ধনে এক জোড়া ইলেকট্রন থাকায় এটি সমযোজী একবন্ধন।
2.3 হাইড্রোজেন ক্লোরাইড অণুর গঠন
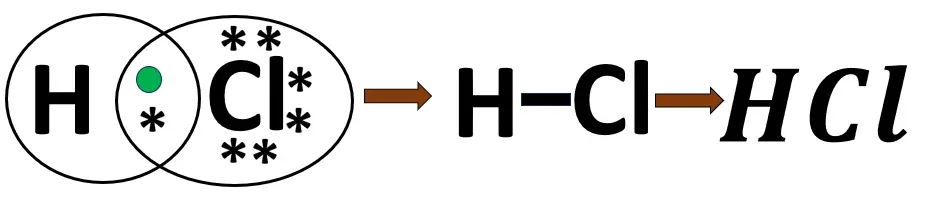
Cl- এর ইলেকট্রন বিন্যাস- 2, 8, 7
H -এর ইলেকট্রন বিন্যাস- 1
H পরমাণুর দ্বৈত পূর্তির জন্য 1টি ইলেকট্রন প্রয়োজন। Cl পরমাণুর অষ্টক পূর্তির জন্যও 1টি ইলেকট্রন প্রয়োজন। এই দুই পরমাণু একে অপরের একটি করে ইলেকট্রন ব্যবহার করে তাদের নিকটবর্তী নিষ্ক্রিয় মৌলের ন্যায় ইলেকট্রন বিন্যাস লাভ করে। বন্ধনে এক জোড়া ইলেকট্রন থাকায় এটি সমযোজী এক বন্ধন।
2.4 হাইড্রোজেন ফ্লুরাইড অণুর গঠন

F- এর ইলেকট্রন বিন্যাস- 2, 7
H -এর ইলেকট্রন বিন্যাস- 1
H পরমাণুর দ্বৈত পূর্তির জন্য 1টি ইলেকট্রন প্রয়োজন। F পরমাণুর অষ্টক পূর্তির জন্যও 1টি ইলেকট্রন প্রয়োজন। এই দুই পরমাণু একে অপরের একটি করে ইলেকট্রন ব্যবহার করে তাদের নিকটবর্তী নিষ্ক্রিয় মৌলের ন্যায় ইলেকট্রন বিন্যাস লাভ করে। বন্ধনে এক জোড়া ইলেকট্রন থাকায় এটি সমযোজী একবন্ধন।
2.5 জলের অণুর গঠন
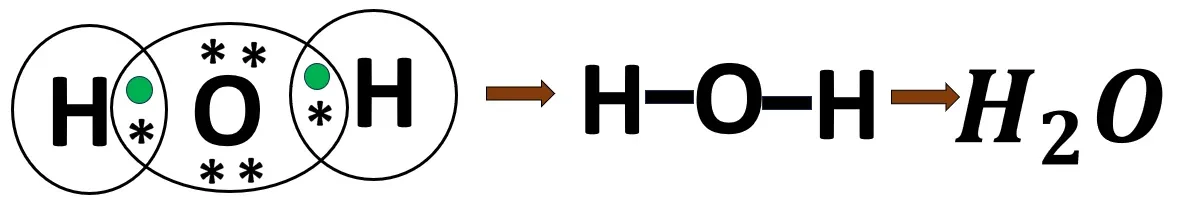
O- এর ইলেকট্রন বিন্যাস- 2, 6
H -এর ইলেকট্রন বিন্যাস- 1
H পরমাণুর দ্বৈত পূর্তির জন্য 1টি ইলেকট্রন প্রয়োজন। O পরমাণুর অষ্টক পূর্তির জন্য 2টি ইলেকট্রন প্রয়োজন। দুটি H পরমাণু; O পরমাণুর থেকে একটি করে ইলেকট্রন ব্যবহার করবে এবং O পরমাণুটিও প্রতিটি H পরমাণু একটি করে ইলেকট্রন ব্যবহার করবে। এর ফলে তারা তাদের নিকটবর্তী নিষ্ক্রিয় মৌলের ন্যায় ইলেকট্রন বিন্যাস লাভ করে। প্রতি বন্ধনে এক জোড়া ইলেকট্রন থাকায় এটি সমযোজী একবন্ধন।
2.6 অ্যামোনিয়া অণুর গঠন
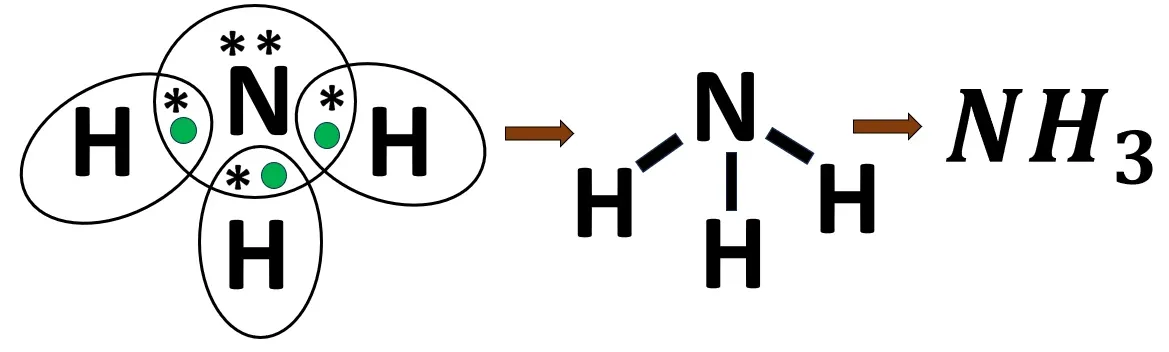
N- এর ইলেকট্রন বিন্যাস- 2, 5
H -এর ইলেকট্রন বিন্যাস- 1
H পরমাণুর দ্বৈত পূর্তির জন্য 1টি ইলেকট্রন প্রয়োজন। N পরমাণুর অষ্টক পূর্তির জন্য 3টি ইলেকট্রন প্রয়োজন। তিনটি H পরমাণু; N পরমাণুর থেকে একটি করে ইলেকট্রন ব্যবহার করবে এবং N পরমাণুটিও প্রতিটি H পরমাণু একটি করে ইলেকট্রন ব্যবহার করবে। এর ফলে তারা তাদের নিকটবর্তী নিষ্ক্রিয় মৌলের ন্যায় ইলেকট্রন বিন্যাস লাভ করে। প্রতি বন্ধনে এক জোড়া ইলেকট্রন থাকায় এটি সমযোজী একবন্ধন।
2.7 মিথেন অণুর গঠন
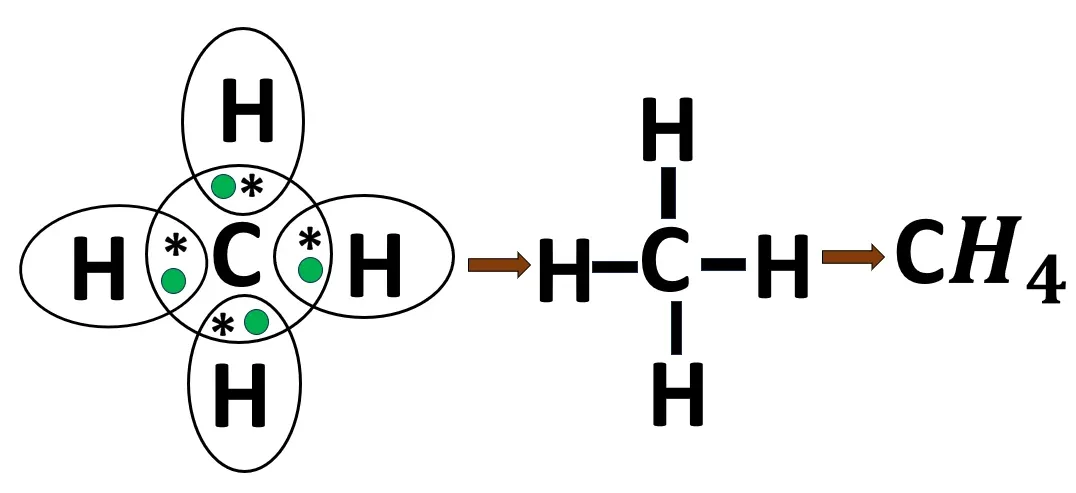
C- এর ইলেকট্রন বিন্যাস- 2, 4
H -এর ইলেকট্রন বিন্যাস- 1
H পরমাণুর দ্বৈত পূর্তির জন্য 1টি ইলেকট্রন প্রয়োজন। C পরমাণুর অষ্টক পূর্তির জন্য 4টি ইলেকট্রন প্রয়োজন। চারটি H পরমাণু; C পরমাণুর থেকে একটি করে ইলেকট্রন ব্যবহার করবে এবং C পরমাণুটিও প্রতিটি H পরমাণু একটি করে ইলেকট্রন ব্যবহার করবে। এর ফলে তারা তাদের নিকটবর্তী নিষ্ক্রিয় মৌলের ন্যায় ইলেকট্রন বিন্যাস লাভ করে। প্রতি বন্ধনে এক জোড়া ইলেকট্রন থাকায় এটি সমযোজী একবন্ধন।
2.8 কার্বন ডাই অক্সাইড অণুর গঠন
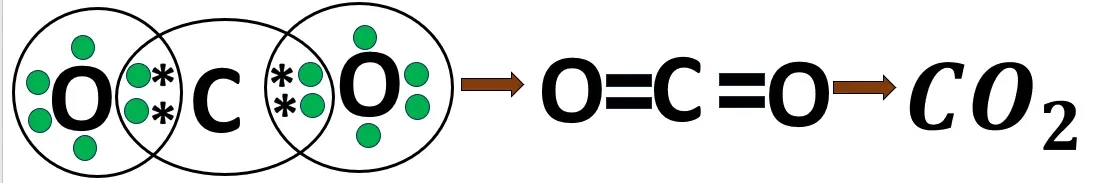
O -এর ইলেকট্রন বিন্যাস- 2, 6
C -এর ইলেকট্রন বিন্যাস- 2, 4
O পরমাণুর অষ্টক পূর্তির জন্য 2টি ইলেকট্রন প্রয়োজন। C পরমাণুর অষ্টক পূর্তির জন্য 4টি ইলেকট্রন প্রয়োজন। 2টি O পরমাণু; C পরমাণুর থেকে দুটি করে ইলেকট্রন ব্যবহার করবে এবং C পরমাণুটিও প্রতিটি O পরমাণু থেকে দুটি করে মোট চারটি ইলেকট্রন ব্যবহার করবে। এর ফলে তারা তাদের নিকটবর্তী নিষ্ক্রিয় মৌলের ন্যায় ইলেকট্রন বিন্যাস লাভ করে। প্রতি বন্ধনে দুই জোড়া ইলেকট্রন থাকায় এটি সমযোজী দ্বিবন্ধন।
2.9 নাইট্রোজেন অণুর গঠন
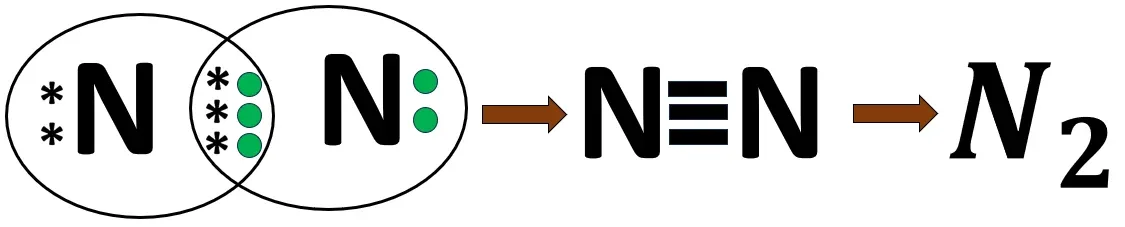
N -এর ইলেকট্রন বিন্যাস- 2, 5
2 টি N পরমাণু একে অপরের 3টি ইলেকট্রন ব্যবহার করে নিকটবর্তী নিষ্ক্রিয় মৌল নিয়ন (Ne)-এর মতো ইলেকট্রন বিন্যাস লাভ করে। বন্ধনে তিন জোড়া ইলেকট্রন থাকায় এটি সমযোজী ত্রিবন্ধন।
2.10 ইথিলিন অণুর গঠন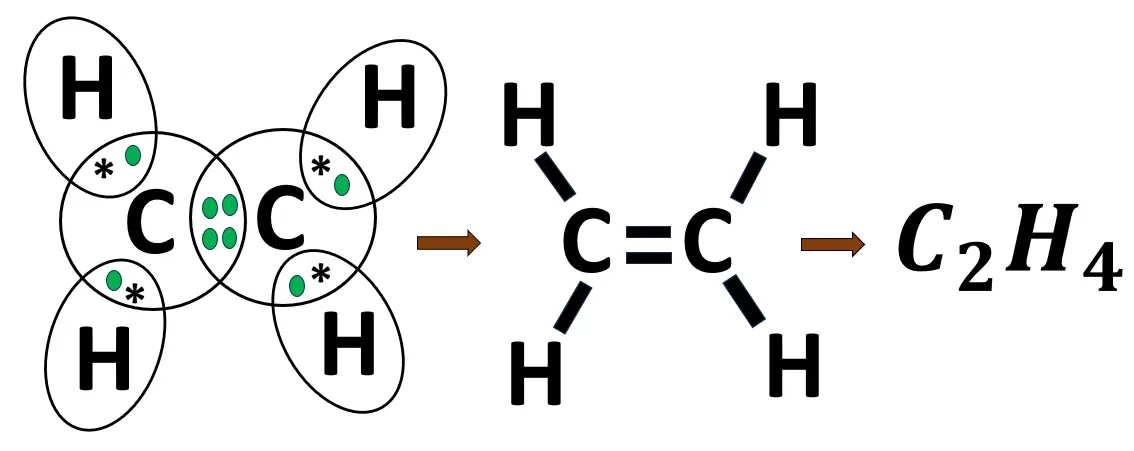
2.11 অ্যাসিটিলিন অণুর গঠন
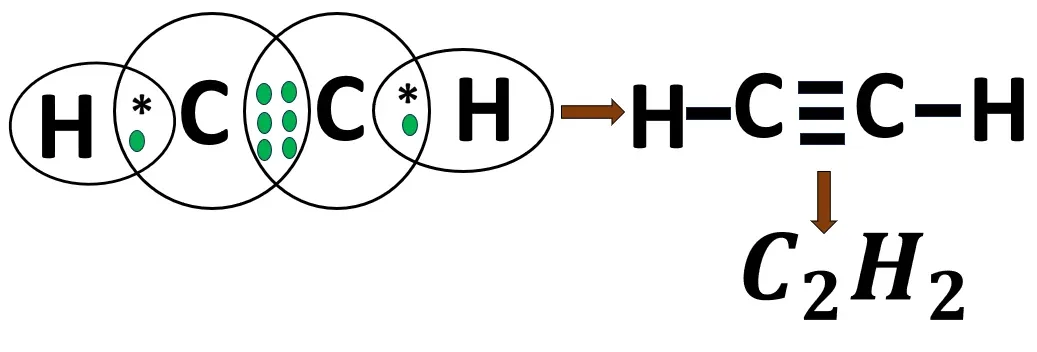
3. আয়নীয় ও সমযোজী যৌগের মধ্যে পার্থক্য
| আয়নীয় যৌগ | সমযোজী যৌগ |
| i) সাধারণত ধাতব ও অধাতব পরমাণু মিলে তৈরি হয়। যেমন- CaCl2 | i) অধাতব পরমাণুদের মধ্যে দেখা যায়। যেমন- NH3 |
| ii) ধ্রুবীয় দ্রাবক (জল)-এ দ্রবীভূত হয়ে আয়ন তৈরি করে। | ii) অধ্রুবীয় দ্রাবক (বেঞ্জিন)-এ দ্রবীভূত হয়। |
| iii) উচ্চ গলনাঙ্ক ও স্ফুটনাঙ্ক। | iii) গলনাঙ্ক ও স্ফুটনাঙ্কের মান নিম্ন হয়। |
| iv) স্বাভাবিক অবস্থায় কঠিন। | v) ঘরের উষ্ণতায় তরল বা গ্যাসীয়। |
| v) সমাবয়বতা লক্ষ্য করা যায় না। | v) সমাবয়বতা লক্ষ্য করা যায়। |





 ABC প্রিজমের প্রতিসারক কোণ ∠A। PQ রশ্মি AC তলে ∠
ABC প্রিজমের প্রতিসারক কোণ ∠A। PQ রশ্মি AC তলে ∠