এখানে যে বিষয়গুলি আছে
Toggle1.পরীক্ষাগার ও রাসায়নিক শিল্পে অজৈব রসায়ন- সঠিক উত্তরটি বেছে নাও
অ্যামোনিয়া
1.1.1 অ্যামোনিয়া থেকে নাইট্রিক অ্যাসিড প্রস্তুতির শিল্প পদ্ধতিকে বলে- a) হেবার পদ্ধতি b) অসওয়াল্ড পদ্ধতি c) লা-ব্ল্যাংক পদ্ধতি d) স্পর্শ পদ্ধতি
সঠিক উত্তর- b) অসওয়াল্ড পদ্ধতি
1.1.2 হিমায়ক রূপে ব্যবহার করা হয় a) O2 b) তরল অ্যামোনিয়া c) H2 d) Cl2
=> সঠিক উত্তর- b) তরল অ্যামোনিয়া
1.1.3 লাইকার অ্যামোনিয়াতে অ্যামোনিয়ার পরিমাণ- a) 17% b) 34% c) 35% d) 40%
সঠিক উত্তর- c) 35%
1.1.4 একটি বিষাক্ত গ্যাস হল- a) NH3 b) H2 c) N2 d) O2
সঠিক উত্তর- a) NH3
1.1.5 নিম্নলিখিত যে মিশ্রণটি উত্তপ্ত করলে অ্যামোনিয়া গ্যাস পাওয়া যায় – a) \mathbf{NH_4NO_3 + Ca (OH)_2} b) \mathbf{ NH_4NO_2+ Ca(OH)_2} c) \mathbf{NH_4Cl + Ca (OH)_2} d) \mathbf{Mg_3N_2 + Ca(OH)_2} ।
সঠিক উত্তর- c)\mathbf{NH_4Cl + Ca (OH)_2}
1.1.6 প্রদত্ত কোনটি আর্দ্র অ্যামোনিয়াকে শুষ্ক করতে ব্যবহৃত হয় ? a) গাঢ় H_2SO_4 b)P_2O_5 c) CaO d) CaCl_2।
সঠিক উত্তর- c) CaO
1.1.7 স্মেলিং সল্ট থেকে প্রাপ্ত গ্যাসটি হল – a) N2 b) H2S c) NH3 d) HCl ।
সঠিক উত্তর- c) NH3
1.1.8 হেবার পদ্ধতিতে অ্যামোনিয়ার শিল্পোৎপাদনে ব্যবহৃত নাইট্রোজেন ও হাইড্রোজেন গ্যাসের আয়তনের অনুপাত- a) 3:2 b) 1:3 c) 3:1 d) 2:3।
সঠিক উত্তর- b) 1:3
1.1.9 হেবার পদ্ধতিতে অ্যামোনিয়া প্রস্তুতির সময় যে অনুঘটকটি ব্যবহৃত হয় তা হল - a) Cu চূর্ণ b) MnO2 c) Pt চূর্ণ d) Fe চূর্ণ ।
সঠিক উত্তর- d) Fe চূর্ণ
1.1.10 নিম্নলিখিত কোন্ পদার্থের মিশ্রণ হেবার পদ্ধতিতে উদ্দীপক রূপে ব্যবহৃত হয় ? a) Fe2O3 + Al2O3 b) Fe2O3 + K2O c) Al2O3 + K2O d)K2O +Cr2O3
সঠিক উত্তর- c) Al2O3 + K2O
1.1.11 জলে সর্বাধিক মাত্রায় দ্রাব্য হল - a) N2 b) NH3 c) H2S d) O2 ।
সঠিক উত্তর-b) NH3
1.1.12 জলীয় দ্রবণে NH3 – a) প্রশম b) তীব্র ক্ষারীয় c) মৃদু ক্ষারীয় d) মৃদু আম্লিক।
সঠিক উত্তর- c) মৃদু ক্ষারীয়
1.1.13 অক্সিজেন গ্যাসের মধ্যে অ্যামোনিয়া গ্যাস জ্বালালে যে বর্ণের শিখা উৎপন্ন করে সেটি হল- a) হলুদ b) নীল c) সবুজ d) বাদামি
সঠিক উত্তর- a) হলুদ
1.1.14 কোনটি ভেজা লাল লিটমাসকে নীল করে? a) CO2 b) HCl c) H2S d) NH3 ।
সঠিক উত্তর- d) NH3
1.1.15 উত্তপ্ত কিউপ্রিক অক্সাইডের মধ্যে দিয়ে অ্যামোনিয়া গ্যাস চালনা করলে উৎপন্ন গ্যাসে প্রধানত থাকে- a) N2 b) H2 c) O2 d) NO
সঠিক উত্তর- a) N2
1.1.16 অ্যামোনিয়ার জলীয় দ্রবণের ধাতব লবণের সঙ্গে বিক্রিয়ায় নীচের কোনটির সাদা আঠালো অধঃক্ষেপ পাওয়া যায়? – a) Al(OH)3 b) CuSO4 c) Fe(OH)3 d) NaCl ।
সঠিক উত্তর- a) Al(OH)3
1.1.17 প্রদত্ত কোন্ ধাতব ক্লোরাইডের উপস্থিতিতে NH4OH যোগ করলে বাদামি বর্ণের অধঃক্ষেপ তৈরি হয়?– a) ZnCl2 b) PbCl2 c) FeCl3 d) CuCl2 ।
সঠিক উত্তর- c) FeCl3
1.1.18 অ্যামোনিয়া শনাক্তকরণে ব্যবহার করা হয় – a) চুনের মিশ্রণ b) BaCl2 দ্রবণ c) AgNO3 দ্রবণ c) নেসলার দ্রবণ।
সঠিক উত্তর- c) নেসলার দ্রবণ
1.1.19 নেসলার দ্রবণের সঙ্গে অ্যামোনিয়া দ্রবণ মেশালে যে অধঃক্ষেপ পড়বে তার রং- a) বাদামি b) লাল c) সাদা d) কালো
সঠিক উত্তর- a) বাদামি
1.1.20 কালাজ্বরের ওষুধ তৈরিতে কোন্ যৌগটি প্রয়োজন হয়? – a) ইউরিয়া b) সালফিউরিক অ্যাসিড c) নাইট্রিক অ্যাসিড d) হাইড্রোজেন সালফাইড।
সঠিক উত্তর- a) ইউরিয়া
হাইড্রোক্লোরিক অ্যাসিড, নাইট্রিক অ্যাসিড, সালফিউরিক অ্যাসিড সম্পর্কিত প্রশ্নের জন্য এখানে ক্লিক করো।
হাইড্রোজেন সালফাইড
1.2.1 H2S গ্যাস সংগ্রহ করা হয়- a)বায়ুর নিম্ন অপসারণ দ্বারা b) জলের নিম্ন অপসারণ দ্বারা c) বায়ুর ঊর্ধ্ব অপসারণ দ্বারা d)জলের উর্দ্ধ অপসারণ দ্বারা
সঠিক উত্তর-c) বায়ুর ঊর্ধ্ব অপসারণ দ্বারা
1.2.2 পরীক্ষাগারে হাইড্রোজেন সালফইড প্রস্তুতিতে ব্যবহৃত কাঁচামালগুলি হল- a) FeS+HNO3 b) Fe2O3+HCl c) FeS+H2SO4 d) Fe2O3+HNO3
সঠিক উত্তর- c) FeS+H2SO4
1.2.3 কোন গ্যাসটিকে কিপ্ যন্ত্রের সাহায্যে প্রস্তুত করা হয়?- a) O2 b) NH3 c) HCl d) H2S
সঠিক উত্তর- d) H2S
1.2.4 হাইড্রোজেন সালফাইডের একটি ভৌত ধর্ম হল- a) তীব্র অ্যাসিডধর্মী b) তীব্র ক্ষারধর্মী c) মৃদু অ্যাসিডধর্মী d) মৃদু ক্ষারধর্মী
সঠিক উত্তর- c) মৃদু অ্যাসিডধর্মী
1.2.5 লেড নাইট্রেট দ্রবণে H2S চালনা করলে যে বর্ণের অধঃক্ষেপ পড়ে তা হল- (a) সাদা (b) কালো (c) নীল (d) সবুজ
সঠিক উত্তর-(b) কালো
1.2.6 H2S গ্যাসের প্রতিষেধক হিসেবে ব্যবহৃত হয়- a) অ্যামোনিয়া b) লঘু ক্লোরিন গ্যাস c) গাঢ় ক্লোরিন গ্যাস d) গাঢ় H2SO4
সঠিক উত্তর- b) লঘু ক্লোরিন গ্যাস
1.2.7 কমলা বর্ণের আম্লিক পটাশিয়াম ডাইক্রোমেট দ্রবণে H2S গ্যাস পাঠালে দ্রবণের অন্তিম বর্ণ কী হবে? a) সাদা b) লাল c) নীল d) সবুজ
সঠিক উত্তর- d) সবুজ
1.2.8 সোডিয়াম নাইট্রোপ্রুসাইড-এর জলীয় দ্রবণে ক্ষারীয় জলীয় দ্রবণে H2S গ্যাস চালনা করলে কী রং উৎপন্ন হয়?- a) বেগুনি b) কমলা c) গাঢ় নীল d) সবুজ
সঠিক উত্তর- বেগুনি
হাইড্রোক্লোরিক অ্যাসিড, নাইট্রিক অ্যাসিড, সালফিউরিক অ্যাসিড সম্পর্কিত প্রশ্নের জন্য এখানে ক্লিক করো।
নাইট্রোজেন
1.3.1 অ্যাজোট (Azote) বলা হয় যে গ্যাসকে সেটি হল- a) অ্যামোনিয়া b) নাইট্রোজেন c) হাইড্রোজেন সালফাইড d) a, c উভয়েই
সঠিক উত্তর- b) নাইট্রোজেন
1.3.2 N2 গ্যাসের পরীক্ষাগারে প্রস্তুতির জন্য প্রদত্ত কোন যৌগদুটির জলীয় মিশ্রণ নেওয়া হয়? a) NaNO2+NH4Cl b) NaNO3+NH4Cl c) NaCl+NH4NO3 d) NaNO3+NH4NO3
সঠিক উত্তর- a) NaNO2+NH4Cl
1.3.3 জলের নিম্ন অপসারণ দ্বারা সংগ্রহ করা হয়- a) NH3 গ্যাস b) H2S গ্যাস c) N2 গ্যাস d) HCl গ্যাস
সঠিক উত্তর- c) N2 গ্যাস
1.3.4 চোখের কর্ণিয়া সংরক্ষণে ব্যবহৃত হয়- a) NO b) H2S c) N2 d) NO2
সঠিক উত্তর- NO2
1.3.5 নাইট্রোজেন বন্ধনের প্রথম ধাপে বিদ্যুৎপাতের ফলে প্রদত্ত কোন যৌগটি উৎপন্ন হয়? - a) NO b) NO2 c) N2O5 d) HNO3
সঠিক উত্তর- a) NO
1.3.6 প্রকৃতিতে যে যৌগে N2 আবদ্ধ থাকে সেটি হল- a) বক্সাইট b) অ্যালুমিনা c) হিমাটাইট d) চিলি সল্টপিটার
সঠিক উত্তর- d) চিলি সল্টপিটার
হাইড্রোক্লোরিক অ্যাসিড, নাইট্রিক অ্যাসিড, সালফিউরিক অ্যাসিড সম্পর্কিত প্রশ্নের জন্য এখানে ক্লিক করো।
2. পরীক্ষাগার ও রাসায়নিক শিল্পে অজৈব রসায়ন-অতি সংক্ষিপ্ত প্রশ্নোত্তর
অ্যামোনিয়া
2.1.1 শূণ্যস্থান পূরণ কর-পরীক্ষাগারে উৎপন্ন NH3 কে শুষ্ক করতে _____ ব্যবহার করা হয়।
=> কলিচুন (CaO)
2.1.2 অ্যামোনিয়াম ক্লোরাইড ও চুনের মিশ্রণকে তাপ দিলে গন্ধযুক্ত কোন যৌগ তৈরি হয়?
=> 2NH4Cl+CaO→2NH3+CaCl2+H2O । অ্যামোনিয়া ( NH3 ) তৈরি হয়।
2.1.3 স্মেলিং সল্ট কাকে বলে?
=> অ্যামোনিয়াম ক্লোরাইড (NH4Cl)-কে স্মেলিং সল্ট বলে।
2.1.4 পরীক্ষাগারে অ্যামোনিয়া প্রস্তুতির প্রয়োজনীয় রাসায়নিক দ্রব্য গুলি কী কী?
=> (i)অ্যামোনিয়া ঘটিত একটি লবণ। যেমন- অ্যামোনিয়াম ক্লোরাইড (NH4Cl)
(ii) একটি ক্ষার। যেমন- পোড়াচুন (CaO) বা কলিচুন [Ca(OH)2]
2.1.5 অ্যামোনিয়া শুষ্ককরণের জন্য কী ব্যবহার করা হয়?
=> পোড়াচুন (CaO)
2.1.6 লাইকার অ্যামোনিয়া কাকে বলে?
=> 0.88 আপেক্ষিক গুরুত্ববিশিষ্ট অ্যামোনিয়ার সম্পৃক্ত জলীয় দ্রবণকে লাইকার অ্যামোনিয়া বলে। এই দ্রবণে 35% অ্যামোনিয়া উপস্থিত।
2.1.7 লাইকার অ্যামোনিয়া ও তরল অ্যামোনিয়ার মধ্যে পার্থক্য কী?
=> লাইকার অ্যামোনিয়া হল একটি গাঢ় জলীয় দ্রবণ। যা ক্ষারধর্মী। অন্যদিকে, অ্যামোনিয়াকে শীতল করে চাপ প্রয়োগ করলে তরলে পরিণত হয়। এটি আবার ক্ষারধর্মী নয়।
2.1.8 অ্যামোনিয়ার জলীয় দ্রবণের সংস্পর্শে লিটমাসের বর্ণের কি পরিবর্তন হবে?
=> নীল
2.1.9 অ্যামোনিয়ার বিজারণ ধর্মের উদাহরণ দাও।
=> উত্তপ্ত কিউপ্রিক অক্সাইড (CuO)-এর ওপর দিয়ে অ্যামোনিয়া চালনা করলে অক্সাইডটি বিজারিত হয় ও নাইট্রোজেন তৈরি হয়।
3CuO+2NH3→3Cu+3H2O+N2↑
2.1.10 অ্যামোনিয়ার জারণ ধর্মের উদাহরণ দাও।
=> 700°C উষ্ণতায় প্লাটিনাম তারজালির মধ্য দিয়ে অ্যামোনিয়া ও অক্সিজেনের মিশ্রণকে দ্রুত চালনা করলে অ্যামোনিয়া জারিত হয়ে নাইট্রিক অক্সাইড উৎপন্ন হয়।
4NH3+5O2→4NO+6H2O
2.1.11 অ্যামোনিয়ার জলীয় দ্রবণে ফেরিক ক্লোরাইড যুক্ত করলে কী বর্ণ ধারণ করবে?
=> বাদামি বর্ণ
2.1.12 অ্যামোনিয়ার জলীয় দ্রবণে অ্যালুমিনিয়াম ক্লোরাইড যুক্ত করলে কী বর্ণ ধারণ করবে?
=> সাদা রং-এর জেলির মতো।
2.1.13 অ্যালুমিনিয়াম ক্লোরাইড এর জলীয় দ্রবণে অ্যামোনিয়ার জলীয় দ্রবণ যোগ করলে যে অধঃক্ষেপ হবে তার সংকেত লেখো।
=> অ্যালুমিনিয়াম হাইড্রক্সাইড [Al(OH)3]
2.1.14 অ্যামোনিয়ার জলীয় দ্রবণে কপার সালফেট যুক্ত করলে কী বর্ণ ধারণ করবে?
=> প্রথমে নীলাভ সাদা বর্ণের বেসিক কপার সালফেট [CuSO4.Cu(OH)2]। অতিরিক্ত অ্যামোনিয়াম হাইড্রক্সাইডের উপস্থিতিতে গাঢ় নীল বর্ণের কিউপ্রো অ্যামোনিয়াম সালফেট তৈরি হয়।
2.1.15 অ্যামোনিয়ার সঙ্গে কোন গ্যাসের বিক্রিয়ায় একটি কঠিন পদার্থ উৎপন্ন হয়?
=> অ্যামোনিয়ার সঙ্গে হাইড্রোজেন ক্লোরাইড (HCl) গ্যাসের বিক্রিয়ায় অ্যামোনিয়াম ক্লোরাইড (NH4Cl) উৎপন্ন হয় যা কঠিন পদার্থ।
2.1.16 ইউরিয়ার রাসায়নিক নাম কী?
=> কার্বামাইড
2.1.17 ইউরিয়ার সংকেত লেখ।
=> CO(NH_2)_2
2.1.18 কালাজ্বরের ওষুধের নাম কী এবং এটি কী থেকে তৈরি হয়?
=> কালাজ্বরের ওষুধ হল ইউরিয়াস্টিবামিন। এটি ইউরিয়া থেকে তৈরি হয়।
2.1.19 ঘুমের ওষুধ বার্বিটিউরেট কি থেকে তৈরি হয়?
=> ইউরিয়া থেকে।
2.1.20 NH3-এর সঙ্গে PbO দ্রবণের বিক্রিয়ায় কী উৎপন্ন হয়? বিক্রিয়ার সমীকরণ দাও।
=>উত্তপ্ত লেড মনোক্সাইডের উপর দিয়ে অ্যামোনিয়া গ্যাস চালনা করলে লেড মনোক্সাইডটি বিজারিত হয় এবং নাইট্রোজেন উৎপন্ন হয়।
3PbO + 2NH_3\rightarrow 3Pb + 3H_2O + N_2
2.1.21 শিল্পে অ্যামোনিয়া উৎপাদনের কাঁচামাল গুলি কী কী?
=> বিশুদ্ধ হাইড্রোজেন ও নাইট্রোজেন।
হাইড্রোজেন সালফাইড
2.2.1 FeS এর সঙ্গে কোন অ্যাসিডের বিক্রিয়ায় H2S গ্যাস উৎপন্ন হয়?
=> FeS+H2SO4(লঘু) → H2S+FeSO4 । লঘু সালফিউরিক অ্যাসিড
2.2.2 হাইড্রোজেন সালফাইড-এর আণবিক ভর কত?
=> 34
2.2.3 হাইড্রোজেন সালফাইডের বাষ্প ঘনত্ব কত?
=> 17
2.2.4 পরীক্ষাগারে হাইড্রোজেন সালফাইড প্রস্তুতিতে কী কী কাঁচামাল ব্যবহার করা হয়?
=> ফেরাস সালফাইড (FeS) ও সালফিউরিক অ্যাসিড (H2SO4) ।
2.2.5 পরীক্ষাগারে হাইড্রোজেন সালফাইড প্রস্তুতির সমীকরণটি লেখো।
=> FeS + H_2SO_4\rightarrow FeSO_4 + H_2S\uparrow
2.2.6 পরীক্ষাগারে হাইড্রোজেন সালফাইড কীভাবে সংগ্রহ করা হয়?
=> বায়ুর নিম্ন অপরাসণ দ্বারা।
2.2.7 H2S থেকে জলীয় বাষ্প কীভাবে দূর করবে?
=> P2O5 দিয়ে চালনা করলে জলীয় বাষ্প মুক্ত করা যায়।
2.2.8 হাইড্রোজেন সালফাইড গ্যাসের গন্ধ কেমন?
=> পচা ডিমের মতো।
2.2.9 হাইড্রোসালফিউরিক অ্যাসিড কাকে বলে?
=> হাইড্রোজেন সালফাইডকে।
2.2.10 H2S গ্যাসের একটি ব্যবহার লেখ।
=> পরীক্ষাগারে বিভিন্ন ধাতব মূলক সনাক্তকরণে ব্যবহার করা হয়।
2.2.11 ক্লোরিন জলের সঙ্গে H2S বিক্রিয়া করে হলুদ বর্ণের অধঃক্ষেপ পড়ে। এই অধঃক্ষেপটি কী?
=> সালফার। Cl_2 + H_2S\rightarrow 2HCl + S\downarrow
2.2.12 কপার সালফেটের সঙ্গে হাইড্রোজেন সালফাইডের বিক্রিয়ার কী উৎপন্ন হয়? বিক্রিয়ার সমীকরণ দেখাও।
=> কালো বর্ণের কপার সালফাইড অধঃক্ষিপ্ত হয়।
CuSO_4 + H_2S\rightarrow H_2SO_4 + CuS\downarrow
2.2.13 লেড নাইট্রেটের সঙ্গে হাইড্রোজেন সালফাইডের বিক্রিয়ার কী উৎপন্ন হয়? বিক্রিয়ার সমীকরণ দেখাও।
=> কালো বর্ণের লেড সালফাইড অধঃক্ষিপ্ত হয়।
Pb(NO_3)_2 + H_2S\rightarrow 2HNO_3 + PbS\downarrow
2.2.14 সিল্ভার নাইট্রেটের সঙ্গে হাইড্রোজেন সালফাইডের বিক্রিয়ার কী উৎপন্ন হয়? বিক্রিয়ার সমীকরণ দেখাও।
=> কালো বর্ণের সিল্ভার সালফাইড অধঃক্ষিপ্ত হয়।
2AgNO_3 + H_2S\rightarrow 2HNO_3 + Ag_2S\downarrow
2.2.15 পুরানো তৈলচিত্র কোন গ্যাসের সংস্পর্শে কালো হয়ে যায়?
=> হাইড্রোজেন সালফাইড (H2S)গ্যাসের সংস্পর্শে।
নাইট্রোজেন
2.3.1 নাইট্রোজেনের পারমাণবিক সংখ্যা কত?
=> 7
2.3.2 নাইট্রোজেনের পারমাণবিক ভর কত?
=> 14.006
2.3.3 নাইট্রোজেন গ্যাস কে আবিষ্কার করেন?
=> ড্যানিয়েল রাদারফোর্ড
2.3.4 নাইট্রোজেন অণুতে বন্ধন শক্তি কত?
=> 225.2 kcal/mol
2.3.5 চিলি সল্টপিটার কাকে বলে?
=> সোডিয়াম নাইট্রেট (NaNO_3)-কে।
2.3.6 ইন্ডিয়ান সল্টপিটার কাকে বলে?
=> পটাসিয়াম নাইট্রেট (KNO_3)-কে।
2.3.7 পরীক্ষাগারে নাইট্রোজেন প্রস্তুতির জন্য প্রয়োজনীয় রাসায়নিক পদার্থ গুলি কী কী?
=> অ্যামোনিয়াম ক্লোরাইড(NH_4Cl) ও সোডিয়াম নাইট্রাইড(NaNO_2)
2.3.8 পরীক্ষাগারে নাইট্রোজেন প্রস্তুতির বিক্রিয়ার সমীকরণটি লেখো।
=> NH_4Cl + NaNO_2\mathop{\rightarrow}\limits^{\Delta}NH_4NO_2 + NaCl
NH_4NO_2\rightarrow N_2\uparrow + H_2O
2.3.9 পরীক্ষাগারে নাইট্রোজেন প্রস্তুতির পর কীভাবে শুষ্ক করা হয়?
=> গাঢ় সালফিউরিক অ্যাসিড দিয়ে চালনা করতে হয়।
2.3.10 নাইট্রোজেন অণুর বন্ধন কী প্রকৃতির?
=> সমযোজী ত্রিবন্ধন।
2.3.11 ম্যাগনেশিয়াম নাইট্রাইডে জলের সঙ্গে কীভাবে বিক্রিয়া করে?
=> গরম জলে এটি আর্দ্র বিশ্লেষিত হয়ে অ্যামোনিয়া ও ধাতব ক্ষার উৎপন্ন করে।
Mg_3N_2 + 6H_2O\rightarrow 3Mg(OH)_2 + 2NH_3\uparrow
2.3.12 নাইট্রোলিমের সংকেত লেখো।
=> CaNCN + C
2.3.13 নাইট্রোলিম কী?
=> ক্যালসিয়াম সায়ানমাইড (CaNCN) ও কার্বনের মিশ্রণকে নাইট্রোলিম বলে।
2.3.14 নাইট্রোজেন ঘটির কয়েকটি সারের নাম ও সংকেত লেখো।
=>নাইট্রোলিম (CaNCN + C), অ্যামোনিয়াম সালফেট ((NH_4)_2SO_4), অ্যামোনিয়াম নাইট্রেট (NH_4NO_3)।
2.3.15 নাইট্রোজেন ঘটিত একটি অজৈব সারের নাম লেখ।
=> অ্যামোনিয়াম সালফেট ((NH_4)_2SO_4)
3. পরীক্ষাগার ও রাসায়নিক শিল্পে অজৈব রসায়ন-সংক্ষিপ্ত প্রশ্নোত্তর
অ্যামোনিয়া
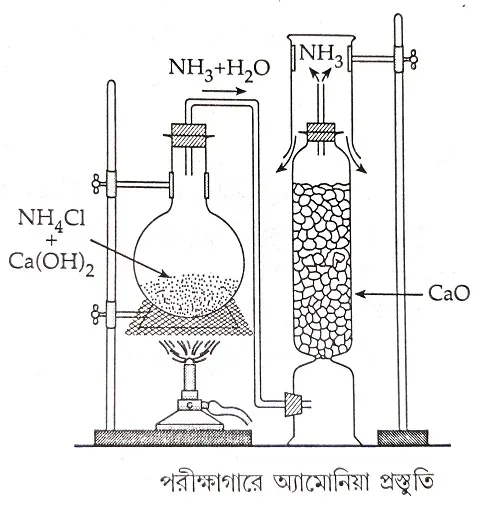
3.1.1 পরীক্ষাগারে অ্যামোনিয়া প্রস্তুতিতে ব্যবহৃত কাঁচামাল ও বিক্রিয়ার সমীকরণটি লেখো।
=> কাঁচামাল- অ্যামোনিয়ার কোনো লবণ। যেমন- অ্যামোনিয়া ক্লোরাইড(NH4Cl), অ্যামোনিয়াম সালফেট((NH4)2SO4) ও। কোনো ক্ষার। যেমন- পোড়াচুন (CaO), কলিচুন (Ca(OH)2), কস্টিক সোডা (NaOH)।
বিক্রিয়া- অ্যামোনিয়ার কোনো লবণের সাথে ক্ষারের মিশ্রণকে তাপ দিলে অ্যামোনিয়া পাওয়া যায়।
NH_4Cl+NaOH \mathop{\rightarrow}\limits^{\Delta} NH_3 \uparrow+NaCl+H_2O
অথবা 2NH_4Cl + CaO\mathop{\rightarrow}\limits^{\Delta} 2NH_3\uparrow + CaCl_2 + H_2O
অথবা (NH_4)_2SO_4 + 2NaOH\mathop{\rightarrow}\limits^{\Delta}2NH_3\uparrow + Na_2SO_4 + 2H_2O
3.1.2 অ্যামোনিয়ার শনাক্তকরণ বিক্রিয়াটি লেখো।
=> (i) হাইড্রোজেন ক্লোরাইড সিক্ত একটি কাচদন্ডকে অ্যামোনিয়ার পাত্রে প্রবেশ করালে সাদা ধোঁয়া তৈরি হয়।
NH_3+HCl\rightarrow NH_4Cl (সাদা ধোঁয়া)
(ii) নেসলার বিকারকের সঙ্গে স্বল্প পরিমাণ অ্যামোনিয়ার সঙ্গে বিক্রিয়া করে বাদামি বর্ণ এবং অতিরিক্ত অ্যামোনিয়ার উপস্থিতিতে বাদামি অধঃক্ষেপ তৈরি করে।
NH_3 + \mathop{2K_2[HgI_4] + 3KOH}\limits_{\textcolor{red}{নেসলার\;বিকারক}} = \mathop{[Hg - O - Hg - NH_2]I\downarrow}\limits_{\textcolor{brown}{বাদামি\;অধঃক্ষেপ} } + 7KI + 2H_2O
3.1.3 লাইকার অ্যামোনিয়ার বোতল খোলার আগের ঠান্ডা করতে হয় কেন?
=> লাইকার অ্যামোনিয়াকে বোতলে উচ্চ চাপে রাখা হয়। সেজন্য যদি বোতল ঠান্ডা না করা হয় তাহলে খোলার সাথে সাথে অ্যামোনিয়া মিশ্রিত জলবিন্দু চোখে প্রবেশ করে দুর্ঘটনা হতে পারে।
3.1.4 নেসলার বিকারক কাকে বলে?
=> পটাশিয়াম ট্রাইআয়োডোমারকিরেটড (II) এর ক্ষারীয় দ্রবণকে নেসলার বিকারক বলে। এর রাসায়নিক সংকেত হল K_2[HgI_4]। এটি অ্যামোনিয়া শনাক্তকরণে ব্যবহার করা হয়।
নেসলার বিকারকের বর্ণ ইষৎ হলুদ বর্ণের হয়। অ্যামোনিয়ার উপস্থিতিতে গাঢ় হলুদ বর্ণ ধারণ করে। তবে অতিরিক্ত অ্যামোনিয়ার উপস্থিতিতে বাদামী বর্ণের অধঃক্ষেপ তৈরি হয়।
3.1.5 অ্যামোনিয়া শুষ্ককরণের জন্য H2SO4 ব্যবহার করা হয় না কেন?
=> অ্যামোনিয়া ক্ষারীয় পদার্থ। অন্যদিকে H2SO4 আম্লিকধর্মী। এই দুটি বিক্রিয়া করে অ্যামোনিয়াম সালফেট লবণ তৈরি করে। সেজন্য অ্যামোনিয়া শুষ্ককরণের জন্য H2SO4 ব্যবহার করা হয় না।
2NH_3 + H_2SO_4\rightarrow (NH_4)_2SO_4
3.1.6 অ্যামোনিয়া শুষ্ককরণের জন্য P2O5 ব্যবহার করা হয় না কেন?
=> অ্যামোনিয়া ক্ষারীয় পদার্থ। অন্যদিকে P2O5 আম্লিক অক্সাইড। আর্দ্র অ্যামোনিয়া ও P2O5 বিক্রিয়া করে অ্যামোনিয়াম ফসফেট লবণ তৈরি করে। সেজন্য অ্যামোনিয়া শুষ্ককরণের জন্য P2O5 ব্যবহার করা হয় না
P_2O_5 + 6NH_3 + 3H_2O\rightarrow 2(NH_4)_3PO_4
3.1.7 অ্যামোনিয়া শুষ্ককরণের জন্য অনার্দ্র CaCl2 ব্যবহার করা হয় না কেন?
=> অ্যামোনিয়ার সঙ্গে CaCl2 বিক্রিয়া করে যুত যৌগ তৈরি করে। তাই অ্যামোনিয়া শুষ্ককরণের জন্য অনার্দ্র CaCl2 ব্যবহার করা হয় না
CaCl_2 + 8NH_3\rightarrow CaCl_2\ldotp 8NH_3
3.1.8 অ্যামোনিয়ার দুটি ভৌত ধর্মের উল্লেখ করো যার সাহায্যে N2 এর সঙ্গে পার্থক্য করা যায়?
=>
| NH3 | N2 |
| তীব্র ঝাঁজালো গন্ধযুক্ত | গন্ধহীন |
| জলে অতিমাত্রায় দ্রাব্য | জলে অদ্রাব্য |
3.1.9 পরীক্ষাগারে NH3 প্রস্তুতিতে ক্ষার হিসেবে NaOH এর চেয়ে CaO কেই বেশি পছন্দ করা হয় কেন?
=> কস্টিক সোডা ক্ষারটি পোড়াচুন বা কলিচুনের থেকে বেশি সক্রিয়। অন্যদিকে, অ্যামোনিয়া প্রস্তুতিতে তাপ প্রয়োগ করতে হয়। উচ্চ তাপমাত্রায় কস্টিক সোডা কাচের পাত্রের সঙ্গে বিক্রিয়া করে সোডিয়াম সিলিকেট তৈরি করতে পারে।। সেজন্য NH3 প্রস্তুতিতে ক্ষার হিসেবে NaOH এর চেয়ে CaO কেই বেশি পছন্দ করা হয়।
3.1.10 NH3 প্রস্তুতির সতর্কতা গুলি লেখো।
=> (i) বিক্রিয়কগুলি কঠিন অবস্থায় থাকে বলে এদের ভালোভাবে গুঁড়ো করে নিতে হবে।
(ii) উৎপন্ন গ্যাস যাতে সহজে বেরিয়ে যায় তাই পাত্রকে অর্ধেক অবস্থায় রেখে তাপ প্রয়োগ করতে হবে।
(iii) গ্যাস যাতে বেরিয়ে না যায় সেজন্য ফ্লাক্সের মুখ ভালো করে বন্ধ করতে হবে।
3.1.11 দুটি জলীয় দ্রবণের একটি ফেরিক ক্লোরাইড ও অপরটি অ্যালুমিনিয়াম ক্লোরাইড। অ্যামোনিয়ার জলীয় দ্রবণের সাহায্যে কিভাবে ফেরিক ক্লোরাইড দ্রবণটি শনাক্ত করবে? সমিত রাসায়নিক সমীকরণ সহ উদাহরণ দাও।
=> দুটিতেই অ্যামোনিয়া গ্যাস চালনা করতে হবে। যে দ্রবণে ফেরিক ক্লোরাইড রয়েছে সেটির বাদামি বর্ণ হবে। অন্যদিকে যে দ্রবণে অ্যালুমিনিয়াম ক্লোরাইড রয়েছে সেটিতে সাদা জেলির মত পদার্থ সৃষ্টি হবে।
FeCl_3 + 3NH_4OH\rightarrow 3NH_4Cl + Fe(OH)_3\downarrow [Fe(OH)3 -এর বাদামি বর্ণের অধঃক্ষেপ]
AlCl_3 + 3NH_4OH\rightarrow 3NH_4Cl + Al(OH)_3\downarrow [Al(OH)3 -এর সাদা জেলি]
3.1.12 অ্যামোনিয়া উৎপাদনের হেবারের পদ্ধতিটি বর্ণনা কর।
=>
আয়রণ চূর্ণ অনুঘটকের উপস্থিতিতে Al2O3 ও K2O চূর্ণের মিশ্রণ বা মলিবডেনাম (Mo) চূর্ণকে উদ্দীপক হিসেবে ব্যবহার করে 550°C উষ্ণতায় শুষ্ক নাইট্রোজেন ও হাইড্রোজেন গ্যাসকে 1:3 আয়তনের অনুপাতে বিক্রিয়া ঘটালে অ্যামোনিয়া তৈরি হয়। এটি একটি উভয় মুখী বিক্রিয়া। বিক্রিয়াটি তাপদায়ী হওয়ায় একবার এটি শুরু হলে আর বাইরের থেকে তাপ দিতে হয় না।
এই প্রক্রিয়ায় উৎপন্ন অ্যামোনিয়ার সঙ্গে নাইট্রোজেন ও হাইড্রোজেন মিশ্রিত অবস্থায় থাকে। সেজন্য মিশ্রণটিকে ঠান্ডা করলে অ্যামোনিয়া তরলে পরিণত হয় এবংনীচে কোনো পাত্রে জমা করা হয়।
N_2 + 3H_2\rightleftharpoons 2NH_3 + 22.4\;kcal
3.1.13 অ্যামোনিয়া ঘটিত কয়েকটি সারের রাসায়নিক নাম ও সংকেত লেখ।
=> অজৈব সার- অ্যামোনিয়াম সালফেট[(NH4)2SO4], অ্যামোনিয়াম ফসফেট[(NH4)3PO4], অ্যামোনিয়াম নাইট্রেট (NH4NO3)
জৈব সার- ইউরিয়া[ CO(NH2)2]
3.1.14 ইউরিয়ার কয়েকটি ব্যবহার লেখ।
=> (i) সার হিসেবে ব্যবহৃত হয়।, (ii) ফরম্যালডিহাইড প্রস্তুতিতে ব্যবহৃত হয়।, (iii) কালাজ্বরের ওষুধ হল ইউরিয়াস্টিবামিন তৈরিতে ইউরিয়া ব্যবহার করা হয়।, (iv) ঘুমের ওষুধ বারবিটিউরেট তৈরিতেও ইউরিয়া ব্যবহৃত হয়।
3.1.15 ইউরিয়ার শিল্প উৎপাদন প্রক্রিয়াটি বর্ণনা কর।
=> 150 atm চাপে 200-210°C উষ্ণতায় অ্যামোনিয়া ও কার্বন ডাই অক্সাইডকে 2:1 আয়তনের অনুপাতে বিক্রিয়া ঘটালে ইউরিয়া উৎপন্ন হয়। বিক্রিয়ার প্রথম পর্যায়ে অ্যামোনিয়াম কার্বামেট উৎপন্ন হয়। পরবর্তীতে অ্যামোনিয়াম কার্বামেট বিয়োজিত হয়ে ইউরিয়া উৎপন্ন করে।
প্রথম ধাপ: 2NH_3 + CO_2\mathop{\huge{\rightleftarrows}}\limits_{150\;atm}^{200^0C - 210^0C}NH_2COONH_4
দ্বিতীয় ধাপ: NH_2COONH_4\rightarrow NH_2CONH_2 \; (ইউরিয়া)+H_2O
হাইড্রোজেন সালফাইড

3.2.1 পরীক্ষাগারে উৎপন্ন হাইড্রোজেন সালফাইডের বিশুদ্ধিকরণ প্রক্রিয়াটি আলোচনা কর।
=> পরীক্ষাগারে উৎপন্ন হাইড্রোজেন সালফাইডের সঙ্গে কিছুটা H2 গ্যাস, H2SO4 বাষ্প ও জলীয় বাষ্প থাকে।
H2SO4 বাষ্প দূরীকরণ- অশুদ্ধ H2S গ্যাসকে সোডিয়াম বাই সালসাইড (NaHS) এর মধ্য দিয়ে চালনা করলে অ্যাসিড বাষ্প দূর হয়।
2NaHS + H_2SO_4\rightarrow Na_2SO_4 + 2H_2S
জলীয় বাষ্প দূরীকরণ- এরপর গ্যাসটিকে P2O5 দিয়ে চালনা করলে জলীয় বাষ্প মুক্ত হবে।
হাইড্রোজেন গ্যাস দূরীকরণ- H2 মিশ্রিত H2S গ্যাসকে শুষ্ক বরফ (CO2) এর মধ্য দিয়ে চালনা করলে H2S গ্যাসে তরলে রূপান্তরিত হবে ও H2 গ্যাস বেরিয়ে যাবে। এরপরে তরল H2S কে উত্তপ্ত করলে বিশুদ্ধ H2S গ্যাস পাওয়া যাবে।
3.2.2 হাইড্রোজেন সালফাইডের ভৌত ধর্মগুলি কী কী?
=> (i) বিষাক্ত, বর্ণহীণ
(ii) পচা ডিমের মতো গন্ধ।
(iii) বাতাস অপেক্ষা ভারী।
(iv) গরম জলে অদ্রাব্য তবে শীতল জলে সামান্য দ্রাব্য।
(v) উচ্চ চাপে শীতল করলে বর্ণহীণ তরলে পরিণত হয়।
3.2.3 হাইড্রোজেন সালফাইড দহণে কী উৎপন্ন হয়?
=> নিয়ন্ত্রিত দহনে গন্ধকের জলীয় বাষ্প ও হলুদ গুঁড়ো তৈরি হয়।
H_2S + O_2\rightarrow 2H_2O + 2S\downarrow
তবে অতিরিক্ত অক্সিজেনের উপস্থিতিতে সালফার ডাই অক্সাইডের সাদা ধোঁয়া তৈরি হয়।
H_2S + 3O_2\rightarrow 2H_2O + 2SO_2
3.2.4 একটি পরীক্ষার সাহায্যে দেখাও যে হাইড্রোজেন সালফাইডের অ্যাসিড ধর্ম আছে।
=> সোডিয়াম হাইড্রক্সাইডের জলীয় দ্রবণে হাইড্রোজেন সালফাইড চালনা হলে বাই সালফাইড ও সালফাইড লবণ তৈরি হয়।
NaOH + H_2S\rightarrow NaHS + H_2O
2NaOH + H_2S\rightarrow Na_2S + 2H_2O
3.2.5 হাইড্রোজেন সালফাইডের বিজারণ ধর্ম দেখাও।
=> পটাশিয়াম ডাইক্রোমেটের আম্লিক দ্রবণে হাইড্রোজেন সালফাইড গ্যাস চালনা করলে হাইড্রোজেন সালফাইড নিজে জারিত হয়ে সালফারের হলুদ অধঃক্ষেপ তৈরি করে এবং সবুজ বর্ণের ক্রোমিক সালফেট লবণ উৎপন্ন করে।
=> K_2Cr_2O_7 + 4H_2SO_4 + 3H_2S\rightarrow K_2SO_4 + Cr_2(SO_4)_3 + 7H_2O + 3S\downarrow
3.2.6 পরীক্ষাগারে হাইড্রোজেন সালফাইডকে বিকারক হিসেবে ব্যবহার করা হয় কেন?
=> হাইড্রোজেন সালফাইডের সাহায্যে ধাতব মূলকের সনাক্তকরণে ব্যবহার করা হয়।
আম্লিক দ্রবণে হাইড্রোজেন সালফাইড গ্যাস চালনা করলে বিভিন্ন বর্ণের ধাতব সালফাইড অধঃক্ষিপ্ত হয়। যেমন- CuS (কালে), PbS (কালো), Ag2S (কালো), HgS (লাল), Bi2S3 (কালচে বাদামী), CdS (হলুদ), As2S3 (কমলা), SnS (হলুদ), Sb2S3 (কালো অথবা সাদা)
আবার, ক্ষারীয় দ্রবণেও কিছু ধাতু অধঃক্ষেপ তৈরি করে। যেমন- ZnS (সাদা), NiS (কালো), CoS (কালো), FeS (ধূসর)
3.2.7 পরীক্ষাগারে কীভাবে হাইড্রোজেন সালফাইড শনাক্ত করা হয়?
=> হাইড্রোজেন সালফাইড গ্যাসকে সদ্য প্রস্তুত সোডিয়াম নাইট্রোপ্রুসাইড দ্রবণে চালনা করলে বেগুনি বর্ণের জটিল যৌগ তোরি হয়। যা হাইডোজেন সালফাইডের উপস্থিতি নিশ্চিত করে।
3.2.8 পুরানো তৈলচিত্র কালো হয়ে যায় কেনো?
=> তৈল চিত্রের যে সাদা রং মূলত লেড অক্সাইড (PbO) দিয়ে তৈরি। এটি বাতাসে উপস্থিত হাইড্রোজেন সালফাইড গ্যাসের সঙ্গে বিক্রিয়া করে কালো বর্ণের লেড সালফাইড (PbS)-এর আস্তরণ তৈরি করে।
PbO\mathop{\rightarrow}\limits^{slow}Pb + O_2;Pb + H_2S\rightarrow PbS(Black) + H_2
নাইট্রোজেন
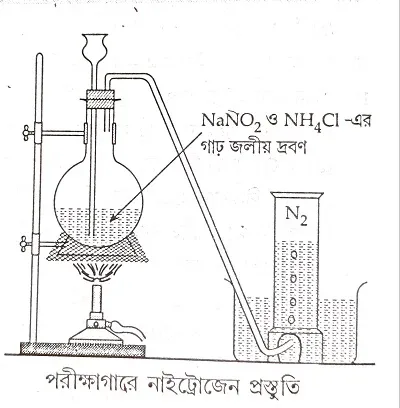
3.3.1 পরীক্ষাগারে সোডিয়াম নাইট্রাইডকে সরাসরি তাপ প্রয়োগ করে নাইট্রোজেন প্রস্তুত করা হয় না কেন?
=> সোডিয়াম নাইট্রাইড হল একটি বিস্ফোরক পদার্থ। এটি ভেঙ্গে গিয়ে প্রচুর তাপ উৎপন্ন করে। তাই সোডিয়াম নাইট্রাইডের জলীয় দ্রবণ প্রস্তুত তাপ দেওয়া হয় যাতে বিস্ফোরণ না হয়।
3.3.2 পরীক্ষাগারে উৎপন্ন নাইট্রোজেনকে কীভাবে বিশুদ্ধ করা হয়?
=> পরীক্ষাগারে উৎপন্ন নাইট্রোজেন এর সঙ্গে কিছুটা নাইট্রোজেনের ঘটিত বিভিন্ন অক্সাইড, ক্লোরিন, অ্যামোনিয়া ও জলীয় বাষ্প থাকে।
গাঢ় কস্টিক সোডার দ্রবণের মধ্য দিয়ে এই গ্যাসকে চালনা করলে প্রথমে ক্লোরিন গ্যাস অপসারণ করা হয়।
2NaOH+Cl_2 \rightarrow NaCl+NaOCl+H_2O
এরপর গাঢ় সালফিউরিক অ্যাসিড এর মধ্য দিয়ে গ্যাসটিকে চালনা করলে অ্যামোনিয়া ও জল দূর হয়।
সবশেষে উত্তপ্ত তামার কুচির ওপর দিয়ে চালনা করলে নাইট্রোজেনের অক্সাইড গুলি বিজারিত হয়ে নাইট্রোজেন উৎপন্ন করে।
2NO + 2Cu\rightarrow N_2 + 2CuO, N_2O + Cu\rightarrow N_2 + CuO
3.3.4 পরীক্ষাগারে উৎপন্ন নাইট্রোজেন গ্যাস কে কিভাবে শনাক্ত করা হয়?
=> একটি জ্বলন্ত ম্যাগনেশিয়াম ফিতে নাইট্রোজেন পূর্ণ গ্যাসজারে প্রবেশ করালে সেটি উজ্জ্বল শিখায় জ্বলে এবং সাদা গুঁড়ো উৎপন্ন করে। এই সাদা গুঁড়ো গরম জলের সঙ্গে বিক্রিয়া করে ঝাঁঝালো গন্ধযুক্ত অ্যামোনিয়া গ্যাস উৎপন্ন করে।
3.3.5 সক্রিয় নাইট্রোজেন কাকে বলে?
=> নিম্নচাপে (<1 mm) নাইট্রোজেন গ্যাসের তড়িৎ ক্ষরণে মৃদু আলো নির্গত হয়। এই প্রদীপ্ত নাইট্রোজেন সাধারণ নাইট্রোজেনের থেকে বেশি সক্রিয়। তাই একে সক্রিয় নাইট্রোজেন বলে
3.3.6 নাইট্রোজেনের কয়েকটি ব্যবহার সম্পর্কে লেখো।
=> (i) নাইট্রিক অ্যাসিড, নাইট্রোলিম, অ্যামোনিয়াম সালফেট, অ্যামোনিয়াম নাইট্রেট প্রস্তুতিতে।
(ii) চিকিৎসায় কোনো অঙ্গকে সক্রিয় রাখা জন্য তরল নাইট্রোজেন ব্যবহার করা হয়।
(iii) প্যাকেটজাত খাদ্য দ্রব্য সংরক্ষনের জন্য।
(iv) বৈদ্যুতিকে বাল্বে ফিলামেন্টকে রক্ষা করার জন্য নাইট্রোজেন ব্যবহার করা হয়।
3.3.7 নাইট্রোজেনের কয়েকটি ব্যবহার সম্পর্কে লেখো।
=> (i) সাধারণ উষ্ণতায় গ্যাসীয় ও নিষ্ক্রিয় প্রকৃতির।
(ii) বর্ণ, স্বাদ ও গন্ধ নেই।
(iii) জলে দ্রাব্যতা খুব কম।
3.3.8 কোন শর্তে নাইট্রোজেন হাইড্রোজেনের সাথে বিক্রিয়া করে?
=> Fe চূর্ণ অণুঘটক ও Mo উদ্দীপকের উপস্থিতিতে 200 atm চাপে 500℃ উষ্ণতায় নাইট্রোজেন ও হাইড্রোজেন উভয়মুখী তাপদায়ী বিক্রিয়ার মাধ্যমে অ্যামোনিয়া উৎপন্ন করে। এটি আসলে হেবারের পদ্ধতি; যার সাহায্যে একসাথে বিপুল পরিমাণ অ্যামোনিয়া একসাথে তৈরি করা হয়।
N_2 + 3H_2\rightleftharpoons 2NH_3 + 22.4\;kcal
3.3.9 কোন শর্তে নাইট্রোজেন অক্সিজেনের সাথে বিক্রিয়া করে?
=> 3000℃ উষ্ণতায় তড়িৎ স্ফুলিঙ্গ হলে নাইট্রোজেন ও অক্সিজেন উভয়মুখী বিক্রিয়া করে নাইট্রিক অক্সাইড তৈরি করে। এটি একটি তাপগ্রাহী বিক্রিয়া।
N_2 + O_2\rightleftharpoons 2NO - 43.3\;kcal
3.3.10 কোন শর্তে নাইট্রোজেন ম্যাগনেশিয়ামের সাথে বিক্রিয়া করে? অথবা, নাইট্রোজেন থেকে কীভাবে ম্যাগনেশিয়াম নাইট্রাইড তৈরি হয়?
=> নাইট্রোজেন ও ম্যাগনেশিয়ামকে একসাথে উৎপত করে ম্যাগনেশিয়াম নাইট্রাইড তৈরি হয়।
3Mg+N_2 \rightarrow Mg_3N_2
3.3.11 নাইট্রোলিম কী? এটি কীভাবে প্রস্তুত করা হয়? নাইট্রোলিম কী কাজে ব্যবহার করা হয়?
=> ক্যালসিয়াম সায়ানামাইড (CaNCN) ও কার্বনের মিশ্রণকে নাইট্রোলিম বলে।
1100℃ উষ্ণতায় ক্যালসিয়াম কার্বাইডের উপর দিয়ে নাইট্রোজেন গ্যাস চালনা করলে নাইট্রোলিম তৈরি হয়।
CaC_2 + N_2\mathop{\rightarrow}\limits^{1100\degree C}CaNCN + C
3.3.12 কীভাবে প্রাকৃতিক উপায়ে বাতাসের নাইট্রোজেন ভূমিতে আবদ্ধ হয়?
=> বজ্রপাতের সময় বায়ুর নাইট্রোজেন ও অক্সিজেন উভয়মুখী বিক্রিয়া করে নাইট্রিক অক্সাইড(NO) তৈরি করে।
O_2 + N_2\mathop{\rightarrow}\limits^{lightning,\;3000\degree C}2NO
এই NO বাতাসের অক্সিজেনের সাথে বিক্রিয়া করে বাদামি বর্ণের নাইট্রোজেন ডাই অক্সাইড তৈরি করে।
2NO + O_2\rightarrow 2NO_2
নাইট্রোজেন ডাই অক্সাইড জলীয় বাষ্প অথবা জলের সাথে বিক্রিয়া করে নাইট্রাস অ্যাসিড (HNO_2) ও নাইট্রিক অ্যাসিড (HNO_3) তৈরি করে।
2NO_2 + H_2O\rightarrow HNO_2 + HNO_3
এই অ্যাসিডগুলি বৃষ্টির সাথে আপতিত হলে ভূপৃষ্ঠের ধাতব যৌগের সাথে বিক্রিয়া করে নাইট্রেট লবণ তৈরি করে।





 ABC প্রিজমের প্রতিসারক কোণ ∠A। PQ রশ্মি AC তলে ∠
ABC প্রিজমের প্রতিসারক কোণ ∠A। PQ রশ্মি AC তলে ∠